题目内容
某元素A的原子M电子层上的电子数是K层电子数的2倍,推测A不可能具有的性质是( )?
| A.单质A晶体的熔沸点高,硬度较大? |
| B.A常见的化合物为+4价? |
| C.A的高价氧化物的水化物H2AO3的酸性比碳酸的酸性强? |
| D.A单质是良好的半导体材料? |
C
K电子层为2个电子,则A原子M层应有4个电子,L层一定达到饱和为8个电子,因此可确定A的原子结构为: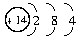 。由结构推知A元素在周期表中的位置,即第3周期ⅣA族元素。A的原子序数为14,应是硅元素。硅的结构类似金刚石,熔点和沸点都很高,硬度也很大。硅的常见化合价为+4,它的导电性介于导体和绝缘体之间,是良好的半导体材料。Si在碳的下一周期,元素的非金属性比碳的非金属性弱,所以Si形成的H2SiO3的酸性比H2CO3要弱,不可能比H2CO3强。
。由结构推知A元素在周期表中的位置,即第3周期ⅣA族元素。A的原子序数为14,应是硅元素。硅的结构类似金刚石,熔点和沸点都很高,硬度也很大。硅的常见化合价为+4,它的导电性介于导体和绝缘体之间,是良好的半导体材料。Si在碳的下一周期,元素的非金属性比碳的非金属性弱,所以Si形成的H2SiO3的酸性比H2CO3要弱,不可能比H2CO3强。
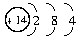 。由结构推知A元素在周期表中的位置,即第3周期ⅣA族元素。A的原子序数为14,应是硅元素。硅的结构类似金刚石,熔点和沸点都很高,硬度也很大。硅的常见化合价为+4,它的导电性介于导体和绝缘体之间,是良好的半导体材料。Si在碳的下一周期,元素的非金属性比碳的非金属性弱,所以Si形成的H2SiO3的酸性比H2CO3要弱,不可能比H2CO3强。
。由结构推知A元素在周期表中的位置,即第3周期ⅣA族元素。A的原子序数为14,应是硅元素。硅的结构类似金刚石,熔点和沸点都很高,硬度也很大。硅的常见化合价为+4,它的导电性介于导体和绝缘体之间,是良好的半导体材料。Si在碳的下一周期,元素的非金属性比碳的非金属性弱,所以Si形成的H2SiO3的酸性比H2CO3要弱,不可能比H2CO3强。
练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目

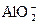 +3H2↑?
+3H2↑?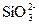 +2H2↑?
+2H2↑?