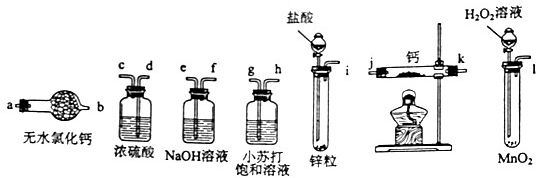
题目内容
氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为-
(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞 (请按正确的顺序填入下列步骤的标号).
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
②该同学的判断不正确,原因是
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是
(1)i→e→f→d→c→j→k(或k→j)→a (2)BADC
(3)CaH2+2H2O=Ca(OH)2+2H2↑;金属钙与水反应也有类似现象;
(4)取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色
(5)氢化钙是固体,携带方便
解析试题分析:(1)氢化钙和金属钙都是极强的还原剂,遇水、遇空气都能发生剧烈反应,因此在制取氢化钙时,必须要除去空气、水等其他杂质;在题给的实验装置中,不难判断出氢气的发生装置,氢气的净化装置和氢化钙的生成装置等,其连接顺序为i→e→f→d→c→j→k(或k→j)→a。
(2)为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯→加热反应→停止加热→继续通氢气至冷却→停止通入氢气,故答案为BADC。
(3)CaH2和Ca与水反应都能产生Ca(OH)2和H2,反应方程式分别为:CaH2+2H2O=Ca(OH)2+2H2↑和Ca+2H2O=Ca(OH)2+H2↑,因此不能根据反应后溶液呈碱性判断是否含有CaH2。
(4)CaH2可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色。所以实验方案是取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色。
(5)作为能源,氢化钙明显比氢气更易携带,使用也较方便。所以其优点是氢化钙是固体,携带方便。
考点:考查氢化钙、金属钙性质的有关实验探究、化学实验基本操作等
点评:该题是高考中的常见题型,试题综合性强,对学生的思维能力要求高,有利于培养学生的综合实验能力,提升学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。