题目内容
17.(1)25mL 4mol•L-1 H2SO4溶液中含有的物质的量为0.1mol;(2)配制100mL 2mol•L-1 Na2SO4溶液需要称量Na2SO428.4g.
分析 (1)根据n=cV求算物质的量;
(2)根据n=cV求算物质的量,再由m=nM计算质量.
解答 解:(1)25mL 4mol•L-1 H2SO4溶液中含有的物质的量为:n=cV=0.025L×4mol/L=0.1mol;
故答案为:0.1mol;
(2)配制100mL 2mol•L-1 Na2SO4溶液,Na2SO4的物质的量为n=cV=0.1L×2mol/L=0.2mol,则其质量为m=nM=0.2mol×142=28.4g;
故答案为:28.4.
点评 本题考查物质的量和物质的量浓度的有关计算,注意把握物质的量的有关公式,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
7.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R的离子结构示意图是 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
(2)M元素的常见单质有二种,它们互称同素异形体,它们的化学式为O2、O3.
(3)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(4)Y与R相比,非金属性较强的元素是Cl,下列事实能证明这一结论的是BC(选填字母序号).
A.常温下Y的单质呈固态,R的单质呈气态 B.稳定性XR>YX4
C.Y与R形成的化合物中Y呈正价 D.在水中的溶解性:X4YM4<XRM4
(5)下列现象或应用与电子在不同能级的轨道上跃迁有关的是ABD.
A.X原子有四种可见光谱谱线 B.Z元素焰色反应呈黄色
C.Y单质可做半导体材料 D.Q单质与氧化铁在高温下剧烈反应并发光、发热.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.(2)M元素的常见单质有二种,它们互称同素异形体,它们的化学式为O2、O3.
(3)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(4)Y与R相比,非金属性较强的元素是Cl,下列事实能证明这一结论的是BC(选填字母序号).
A.常温下Y的单质呈固态,R的单质呈气态 B.稳定性XR>YX4
C.Y与R形成的化合物中Y呈正价 D.在水中的溶解性:X4YM4<XRM4
(5)下列现象或应用与电子在不同能级的轨道上跃迁有关的是ABD.
A.X原子有四种可见光谱谱线 B.Z元素焰色反应呈黄色
C.Y单质可做半导体材料 D.Q单质与氧化铁在高温下剧烈反应并发光、发热.
5.下列对$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)═HI(g)△H=+26kJ•mol-1的叙述中,正确的是( )
| A. | 1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52kJ的热量 | |
| C. | 1mol H2(g)与1mol I2(g)完全反应生成2mol的HI(g)需吸收52kJ的热量 | |
| D. | 1mol H2(g)与1mol I2(g)完全反应放出26kJ的热量 |
2.下列反应不属于离子反应的是 ( )
| A. | Ca(OH)2+2HCl═CaCl2+H2O | |
| B. | 2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O | |
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | |
| D. | Cl2+H2O═HCl+HClO |
6.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | A和B都是元素周期表的主族金属元素,B的最高价氧化物的水化物能被A的最高价氧化物的水化物溶解 | |
| D. | A原子最外层电子数比B原子的最外层电子数少 |
7.下列实验需要使用温度计的是( )
| A. | 制取溴苯 | B. | 工业乙醇的蒸馏 | C. | 制硝基苯 | D. | 制乙炔 |
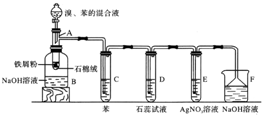
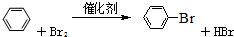 .
. 如图1所示是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1所示是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题: