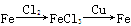题目内容
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)__________________________________________________。
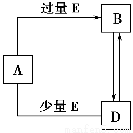
(2)实验室中还可以采用如图装置(略去了夹持装置)和药品快速制备氨气:
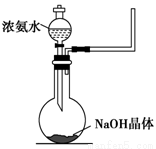
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O  NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图,装置B中盛装的干燥剂是________。
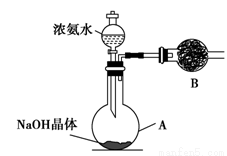
②该同学利用图装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:____________________________________________________。

(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O (2)①c ②3
2NH3↑+CaCl2+2H2O (2)①c ②3
(3)①碱石灰 ②用一手指肚堵住塑料瓶上的小孔,然后轻轻挤压塑料瓶,将少量水挤入烧瓶,手指肚离开小孔
【解析】(2)第二种制备氨气的方法中利用了一水合氨的分解反应,与铵盐、熟石灰的反应原理不同;若10 mL 34%的0.89 g·mL-1的浓氨水中的NH3·H2O全部分解,生成的NH3的物质的量为10 mL×34%×0.89 g·mol-1÷35 g·mol-1=0.086 5 mol,标准状况下的体积为0.086 5 mol×22.4 L·mol-1=1.937 6 L,用体积为0.5 L的烧瓶收集时,因为最后一瓶收集不满,故最多只能收集满3个烧瓶。(3)干燥管中只能盛装固体干燥剂,但氨气不能用无水氯化钙干燥。