题目内容
在某100 mL混合溶液中,HNO3和H2SO4的物质的量浓度分别为0.400 mol·L-1和0.100 mol·L-1,向该混合溶液中加入1.92 g铜粉,加热使其充分反应,若反应前后溶液体积视作不变,反应后溶液中Cu2+的物质的量浓度为( )
| A.0.15 mol·L-1 | B.0.225 mol·L-1 |
| C.0.3 mol·L-1 | D.0.6 mol·L-1 |
B
溶液中n(H+)="0.1" L×0.4 mol·L-1+0.1 L×0.1 mol·L-1×2="0.06" mol
n(Cu)=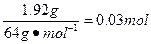
n(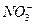 )="0.1" L×0.4 mol·L-1="0.04" mol
)="0.1" L×0.4 mol·L-1="0.04" mol
3Cu + 8H++ 2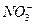 ====3Cu2++2NO↑+4H2O
====3Cu2++2NO↑+4H2O
0.03 mol 0.06 mol 0.04 mol
因n(H+)不足,故只消耗Cu: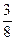 ×0.06="0.0225" mol
×0.06="0.0225" mol
c(Cu2+)=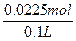 ="0.225" mol·L-1
="0.225" mol·L-1
n(Cu)=
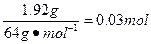
n(
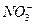 )="0.1" L×0.4 mol·L-1="0.04" mol
)="0.1" L×0.4 mol·L-1="0.04" mol3Cu + 8H++ 2
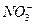 ====3Cu2++2NO↑+4H2O
====3Cu2++2NO↑+4H2O0.03 mol 0.06 mol 0.04 mol
因n(H+)不足,故只消耗Cu:
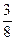 ×0.06="0.0225" mol
×0.06="0.0225" molc(Cu2+)=
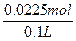 ="0.225" mol·L-1
="0.225" mol·L-1
练习册系列答案
相关题目
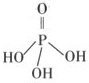
 H
H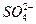 ====BaSO4↓来表示的是( )
====BaSO4↓来表示的是( )