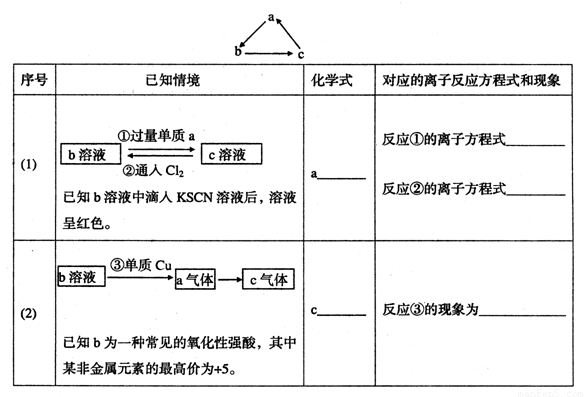
题目内容
( 10分)下列物质:①NaCl固体②无水乙醇③稀硫酸④BaSO4固体⑤冰醋酸⑥H2⑦CO2⑧熔融的KOH(选序号填空)
(1)能导电:_____________(2)非电解质:_____________________
(3)强电解质:_____________(4)弱电解质:____________________
(5)已知25℃时两种酸的电离常数:
Ka(CH3COOH)=1.75×10-5, Ka(HClO)=3.0×10-8
判断该反应是否能发生,若能,完成反应方程式;若不能,无需。
CH3COOH + Ca(ClO)2 ——
( 10分)(1)③⑧ (2)②⑦ (3)①④⑧ (4)⑤
(5)2CH3COOH + Ca(ClO)2= (CH3COO)2 Ca + 2HClO
【解析】(1)电解质导电必须有自由运动的阴阳离子,所以能导电的是③⑧。
(2)溶于水和在熔融状态下均不能导电的化合物是非电解质,所以答案是②⑦。
(3)在溶液中完全电离,不存在电离平衡的是强电解质,所以答案选①④⑧ 。
(4)在溶液中没有完全电离,存在电离平衡的是弱电解质,所以答案选⑤。
(5)电离常数越大,电离程度越大,所以根据电离常数可知,醋酸的酸性强于次氯酸的,因此根据较强的酸制取较弱的酸可知,反应可以发生,方程式为2CH3COOH + Ca(ClO)2= (CH3COO)2 Ca + 2HClO。

 阅读快车系列答案
阅读快车系列答案(10分)有下列5中有机物
①CH4 ②CH2=CH2 ③CH3CH2OH ④ ⑤CH3COOH
⑤CH3COOH
(1)选用上述物质的序号填空:
天然气的主要成分是_________________,白酒中的主要成分是________,能够催熟水果的是_______,不能使酸性高锰酸钾溶液褪色的液态烃是___________
(2)⑤中含有的官能团的名称___________,将②通入溴的四氯化碳溶液中发生的反应类型属于_______反应,下列物质中与①互称为同系物的是___________
| A.乙烯 | B.氯乙烷 | C.乙烷 | D.乙醇 |
(10分)(1)下列分子中,其核磁共振氢谱中只有一个峰(信号)的物质是__________.
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3COCH3 |
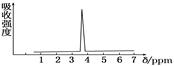
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_______________