题目内容
海水晶是通过对海水进行蒸发生产出来的一种盐化工产品,是浓缩的海水,海水晶经过加水可复原成海水,用于在淡水区进行海产品养殖.相对于粗海盐兑制的海水,更能适合海洋生物的生长.
(1)实验室中用粗盐制成精盐过程中通常经过以下途径:
①粗盐加水溶解 ②向溶液中加入过量氢氧化钠溶液 ③加入
⑥加入盐酸调节PH近似为7 ⑦
(2)第⑥步中加入盐酸过多,对精制实验有什么危害
(3)海水晶比粗海盐兑制的海水,更能适合海洋生物的生长的原因可能是
(4)某盐湖的水中含有较高浓度的NaI和NaBr,向溶液中加入淀粉并慢慢通入氯气,溶液先变蓝色后褪成无色,后又变成橙色,加入CCl4后,下层红棕色,经检验上层无色溶液中含有IO3-,回答下列问题:
①蓝色褪成无色的化学方程式
②Br-、I-、I2 三种粒子的还原性由强到弱顺序是
③将下层红棕色CCl4分离的玻璃仪器是
④将溴仅以Br-的形式从CCl4层全部转移到水层可用试剂是
A Na2CO3 B Na2SO3 C KMnO4(H2SO4) D Na2S E 苯酚溶液.
(1)实验室中用粗盐制成精盐过程中通常经过以下途径:
①粗盐加水溶解 ②向溶液中加入过量氢氧化钠溶液 ③加入
过量氯化钡溶液
过量氯化钡溶液
④加入过量碳酸钠溶液
过量碳酸钠溶液
⑤过滤
过滤
⑥加入盐酸调节PH近似为7 ⑦
蒸发结晶
蒸发结晶
(2)第⑥步中加入盐酸过多,对精制实验有什么危害
蒸发时因氯化氢挥发而污染环境
蒸发时因氯化氢挥发而污染环境
.(3)海水晶比粗海盐兑制的海水,更能适合海洋生物的生长的原因可能是
海水晶中仍保留海水的一些微量元素,粗海盐中可能不含这些元素
海水晶中仍保留海水的一些微量元素,粗海盐中可能不含这些元素
.(4)某盐湖的水中含有较高浓度的NaI和NaBr,向溶液中加入淀粉并慢慢通入氯气,溶液先变蓝色后褪成无色,后又变成橙色,加入CCl4后,下层红棕色,经检验上层无色溶液中含有IO3-,回答下列问题:
①蓝色褪成无色的化学方程式
I2+5Cl2+6H2O═2HIO3+10HCl
I2+5Cl2+6H2O═2HIO3+10HCl
;②Br-、I-、I2 三种粒子的还原性由强到弱顺序是
I->I2>Br-
I->I2>Br-
;③将下层红棕色CCl4分离的玻璃仪器是
分液漏斗、烧杯
分液漏斗、烧杯
;④将溴仅以Br-的形式从CCl4层全部转移到水层可用试剂是
BD
BD
A Na2CO3 B Na2SO3 C KMnO4(H2SO4) D Na2S E 苯酚溶液.
分析:(1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(2)根据盐酸能污染环境;
(3)根据海水晶中仍保留海水的一些微量元素,能促进海洋生物的生长;
(4)①向溶液中加入淀粉并慢慢通入氯气,溶液先变蓝色后褪成无色,先是将KI中的I元素氧化成碘单质,然后碘单质进一步氧化成碘酸,据此写出反应物、生成物,用化合价升降法来配平;
②根据同一氧化剂与不同还原剂反应,根据反应的先后顺序来判断还原剂还原性的强弱;
③根据分液是将互不相溶的两种液体用分液漏斗分开;
④根据单质溴与各物质反应是否将溴仅以Br-的形式从CCl4层全部转移到水层.
(2)根据盐酸能污染环境;
(3)根据海水晶中仍保留海水的一些微量元素,能促进海洋生物的生长;
(4)①向溶液中加入淀粉并慢慢通入氯气,溶液先变蓝色后褪成无色,先是将KI中的I元素氧化成碘单质,然后碘单质进一步氧化成碘酸,据此写出反应物、生成物,用化合价升降法来配平;
②根据同一氧化剂与不同还原剂反应,根据反应的先后顺序来判断还原剂还原性的强弱;
③根据分液是将互不相溶的两种液体用分液漏斗分开;
④根据单质溴与各物质反应是否将溴仅以Br-的形式从CCl4层全部转移到水层.
解答:解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,蒸发结晶得到氯化钠,故答案为:过量氯化钡溶液;过量碳酸钠溶液;过滤;蒸发结晶;
(2)蒸发时因氯化氢挥发而污染环境,故答案为:蒸发时因氯化氢挥发而污染环境;
(3)因海水晶中仍保留海水的一些微量元素,能促进海洋生物的生长,故答案为:海水晶中仍保留海水的一些微量元素,粗海盐中可能不含这些元素;
(4)①I元素的化合价从0→+5,升高5价,Cl元素的化合价从0→-1,降低1价,根据得失电子守恒和质量守恒,得:I2+5Cl2+6H2O═2HIO3+10HCl,
故答案为:I2+5Cl2+6H2O═2HIO3+10HCl;
②向溶液中加入淀粉并慢慢通入氯气,溶液先变蓝色后褪成无色,后又变成橙色,会先后发生这几个反应:
Cl2+2NaI═I2+2NaCl,溶液变紫色;
I2+5Cl2+6H2O═2HIO3+10HCl 褪成无色;
Cl2+2NaBr═Br2+2NaCl,溶液颜色变成橙色;
由还原剂的还原性大于还原产物的还原性可知还原性强弱顺序为:I->I2>Br-,
故答案为:I->I2>Br-;
③因下层红棕色CCl4不溶于水,可用分液的方法分离,故答案为:分液漏斗、烧杯;
④A、溴能与Na2CO3溶液反应生成溴化钠、次溴酸钠、二氧化碳,溴未以Br-的形式从CCl4层全部转移到水层,故A错误;
B、溴能与Na2SO3溶液反应生成硫酸钠、溴化氢,溴仅以Br-的形式从CCl4层全部转移到水层,故B正确;
C、溴与KMnO4(H2SO4)不反应,溴未以Br-的形式从CCl4层全部转移到水层,故C错误;
D、溴能与Na2S溶液反应生成溴化钠、单质硫,溴仅以Br-的形式从CCl4层全部转移到水层,故D正确;
E、溴能与苯酚溶液反应生成三溴苯酚、溴化氢,三溴苯酚溶于CCl4,溴未以Br-的形式从CCl4层全部转移到水层,故E错误;
故选:BD.
(2)蒸发时因氯化氢挥发而污染环境,故答案为:蒸发时因氯化氢挥发而污染环境;
(3)因海水晶中仍保留海水的一些微量元素,能促进海洋生物的生长,故答案为:海水晶中仍保留海水的一些微量元素,粗海盐中可能不含这些元素;
(4)①I元素的化合价从0→+5,升高5价,Cl元素的化合价从0→-1,降低1价,根据得失电子守恒和质量守恒,得:I2+5Cl2+6H2O═2HIO3+10HCl,
故答案为:I2+5Cl2+6H2O═2HIO3+10HCl;
②向溶液中加入淀粉并慢慢通入氯气,溶液先变蓝色后褪成无色,后又变成橙色,会先后发生这几个反应:
Cl2+2NaI═I2+2NaCl,溶液变紫色;
I2+5Cl2+6H2O═2HIO3+10HCl 褪成无色;
Cl2+2NaBr═Br2+2NaCl,溶液颜色变成橙色;
由还原剂的还原性大于还原产物的还原性可知还原性强弱顺序为:I->I2>Br-,
故答案为:I->I2>Br-;
③因下层红棕色CCl4不溶于水,可用分液的方法分离,故答案为:分液漏斗、烧杯;
④A、溴能与Na2CO3溶液反应生成溴化钠、次溴酸钠、二氧化碳,溴未以Br-的形式从CCl4层全部转移到水层,故A错误;
B、溴能与Na2SO3溶液反应生成硫酸钠、溴化氢,溴仅以Br-的形式从CCl4层全部转移到水层,故B正确;
C、溴与KMnO4(H2SO4)不反应,溴未以Br-的形式从CCl4层全部转移到水层,故C错误;
D、溴能与Na2S溶液反应生成溴化钠、单质硫,溴仅以Br-的形式从CCl4层全部转移到水层,故D正确;
E、溴能与苯酚溶液反应生成三溴苯酚、溴化氢,三溴苯酚溶于CCl4,溴未以Br-的形式从CCl4层全部转移到水层,故E错误;
故选:BD.
点评:本题主要考查了在粗盐提纯中的物质的除杂或净化操作,在解此类题时,首先要了解需要除去的是哪些离子,然后选择适当的试剂进行除杂,在除杂质时,要注意加入试剂的量的控制,同时还考查氧化还原反应的配平、氧化剂和还原剂、还原性强弱的判断.

练习册系列答案
相关题目
 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________, 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,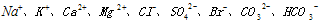 等离子。
等离子。