��Ŀ����
����Ŀ������Ӧ����㷺�Ľ����������Ȼ���������Լ������ĺ������ξ�Ϊ��Ҫ�����
��1����ʵ�����У�FeCl2�������ۺ�___(������)��Ӧ�Ʊ���
��2��Fe3O4���ö��ַ����Ƶã�������һ�ֵ��ʺ�һ�ֻ�����ͨ�����Ϸ�Ӧ�Ʊ��Ļ�ѧ����ʽΪ___��
��3��ʵ�������Ʊ�Fe(OH)2ʱ���������������������������___����Ӧ�Ļ�ѧ����ʽΪ___��
��4����ש������������ս���ɵģ����京��Fe2O3�ʺ�ɫ���غ�ɫ���������������������ϡ������һ����ʵ��֤����ש�к���Fe3+��___��
��5������һ����FeCl2��FeCl3�Ļ������Ʒ��ʵ����n(Fe)��n(C1)=1��2.1�������Ʒ��FeCl3�����ʵ�������Ϊ___��
��6���������(K2FeO4)��һ��ǿ������������Ϊˮ��������������ز��ϡ�FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4���䷴Ӧ�����ӷ���ʽΪ��___��
���𰸡�ϡ������Ȼ�����Һ 6FeO+O2![]() 2Fe3O4(��4Fe2O3+Fe
2Fe3O4(��4Fe2O3+Fe![]() 3Fe3O4) ��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���� 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ����Ʒ���飬��������ݺ�ȡ�ϲ���Һ���μ�KSCN��Һ���Ժ�ɫ 10% 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
3Fe3O4) ��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���� 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ����Ʒ���飬��������ݺ�ȡ�ϲ���Һ���μ�KSCN��Һ���Ժ�ɫ 10% 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
��������
��1����ʵ�����У�FeCl2�������ۺ����ᷴӦ�Ʊ���Fe+2HCl=FeCl2+H2����
��2��FeO�ڿ����м��ȣ����ɵõ�Fe3O4��Ҳ�����������ۺ�Fe2O3�������Ϸ�Ӧ��ȡFe3O4����ѧ����ʽΪ6FeO+O2![]() 2Fe3O4(��4Fe2O3+Fe
2Fe3O4(��4Fe2O3+Fe![]() 3Fe3O4)��
3Fe3O4)��
��3��Fe(OH)2���ױ������е����������������Ʊ�ʱ������������������ɫ��Fe(OH)2��Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��������ѧ����ʽΪ4Fe(OH)2+O2+2H2O= 4Fe(OH)3��
��4�������ש�к���Fe3+����ʹFe2O3�е�+3����ת��ΪFe3+��Ȼ����KSCN��Һ����Fe3+�������ǽ���Ʒ���飬��������ݺ�ȡ�ϲ���Һ���μ�KSCN��Һ���Ժ�ɫ��
��5����FeCl2��FeCl3�����ʵ����ֱ�Ϊx��y����(x+y)��(2x+3y)= 1��2.1�����x=9y�������Ʒ��FeCl3�����ʵ�������Ϊ10%��
��6��FeCl3��KClO��ǿ���������·�Ӧ����ȡK2FeO4�����Ļ��ϼ����ߣ�����KClO��Cl�Ļ��ϼ۽�������Cl-���䷴Ӧ�����ӷ���ʽΪ��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O��

 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�����Ŀ���������������Ṥҵ�Ļ�����������Pt���������·�������Ӧ�����Ӧ��
��.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H1=-905 kJ/mol
4NO(g)+6H2O(g) ��H1=-905 kJ/mol
��.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H2
2N2(g)+6H2O(g) ��H2
��1����֪��
�����ж���1mol��ѧ����Ҫ������/kJ | NO | O2 | N2 |
629 | 496 | 942 |
���H2=___________��
��2����PtΪ��������1L�ܱ������г���1mol NH3��2mol O2������й����ʵ������¶ȵĹ�ϵ����ͼ��
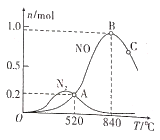
�ٸô����ڸ���ʱ�Է�Ӧ__________�������������
��520��ʱ��NH3��ת����Ϊ____________��
��520��ʱ����Ӧ���ƽ�ⳣ��K=________�����ּ���ʽ����
������˵����ȷ����____________�����ţ���
A ��ҵ�ϰ�����������NOʱ������¶�Ӧ������840������
B ����NH3��O2�ij�ʼͶ�ϱȿ������NH3����NO��ƽ��ת����
C Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�ȿ������NH3����NO��ƽ��ת����
D ʹ�ô���ʱ���ɽ��ͷ�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
���¶ȸ���840��ʱ��NO�����ʵ������ٵ�ԭ�������____________��
��3�������������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2��
��NH3��NO2����N2�ķ�Ӧ�У�������1mol N2ʱ��ת�Ƶĵ�����Ϊ___________mol��
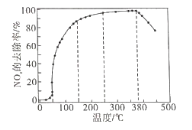
�ڽ�һ��������O2��NH3��NOx�Ļ�����壬����ͨ��װ�д����ķ�Ӧ���з�Ӧ��
��Ӧ��ͬʱ��NOx��ȥ�����淴Ӧ�¶ȵı仯��������ͼ��ʾ����50-250�淶Χ�������¶ȵ����ߣ�NOx��ȥ������Ѹ��������������������Ҫԭ����_______________��
����Ŀ��������(CH3OCH3)����Ϊ21���͵�����ȼ�ϣ���CO��H2Ϊԭ��������������Ҫ��������������Ӧ��
��1���ù��յ��ܷ�ӦΪ3CO(g)��3H2(g)![]() CH3OCH3(g)��CO2(g) ��H��_________����ѧƽ�ⳣ��K��______________(�ú�K1��K2��K3�Ĵ���ʽ��ʾ)��
CH3OCH3(g)��CO2(g) ��H��_________����ѧƽ�ⳣ��K��______________(�ú�K1��K2��K3�Ĵ���ʽ��ʾ)��
��ѧ��Ӧ����ʽ | ��ѧƽ�ⳣ�� | |
��CO(g)��2H2(g) | ��H1=-99 kJmol-1 | K1 |
��2CH3OH(g) | ��H2����24 kJmol-1 | K2 |
��CO(g)��H2O(g) | ��H3����41 kJmol-1 | K3 |
��2��ij�¶��£���8.0molH2��4.0molCO�����ݻ�Ϊ2L���ܱ������У�������Ӧ��4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g)��10 ���Ӻ�Ӧ��ƽ�⣬��ö����ѵ��������Ϊ25%������H2��ʾ�ķ�Ӧ����Ϊ_________��CO��ת����Ϊ________��
CH3OCH3(g)+H2O(g)��10 ���Ӻ�Ӧ��ƽ�⣬��ö����ѵ��������Ϊ25%������H2��ʾ�ķ�Ӧ����Ϊ_________��CO��ת����Ϊ________��
��3�����д�ʩ�У������CH3OCH3���ʵ���________��
A������������� B�������¶� C�����ø�Ч����D������ѹǿ
��4���ù����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ����________________��