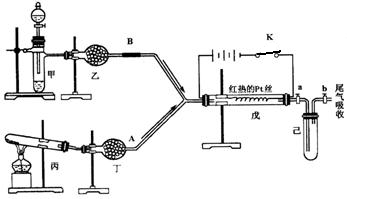
题目内容
(本题共12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀盐酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
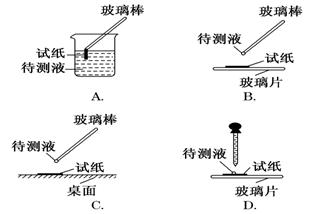
(1)在实验①中,下图所示的操作中正确的是________(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②③两个实验有关的离子方程式:
②________________________________;③_____________________________________
【答案】
(1)BD
(2)Al3+、NO3-、SO42- Fe3+、Ba2+、HCO3- (3)3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O,
2NO+O2===2NO2 Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【解析】A项,不能把试纸放入溶液中检验待测液;C项,直接放在桌面上会造成污染,会引起误差;B、D正确。由于溶液无色透明排除了Fe3+的存在;由①可知溶液显酸性,排除了HCO3-的存在;由②可知NO3-一定存在;由③可知Al3+存在;由④可知SO42-存在,那么排除了Ba2+的存在;由于④引入了Cl-,所以⑤无法证明原溶液中是否含Cl-;所有实验没有证明K+是否存在。

练习册系列答案
相关题目