题目内容
在标准状况下氢气和一氧化碳的混合气体6.72L,质量为3.2g,求H2和CO的质量和体积
m(H2)=0.4g,m(CO)=2.8g;V(H2)=4.48L,V(CO)=2.24L
m(H2)=0.4g,m(CO)=2.8g;V(H2)=4.48L,V(CO)=2.24L
.分析:计算混合气体总的物质的量,令H2和CO的物质的量分别为xmol、ymol,根据二者质量之和与物质的量之和列方程计算x、y的值,再根据m=nM计算各自的质量,根据V=nVm计算各自的体积.
解答:解:混合气体的总的物质的量
=0.3mol,
令H2和CO的物质的量分别为xmol、ymol,根据二者质量之和与体积之和列方程,则:
解得,x=0.2,y=0.1
m(H2)=0.2mol×2g/mol=0.4g,
m(CO)=0.1mol×28g/mol=2.8g,
V(H2)=0.2mol×22.4L/mol=4.48L,
V(CO)=0.1mol×22.4L/mol=2.24L,
故答案为:m(H2)=0.4g,m(CO)=2.8g;V(H2)=4.48L,V(CO)=2.24L.
| 6.72L |
| 22.4L/mol |
令H2和CO的物质的量分别为xmol、ymol,根据二者质量之和与体积之和列方程,则:
|
解得,x=0.2,y=0.1
m(H2)=0.2mol×2g/mol=0.4g,
m(CO)=0.1mol×28g/mol=2.8g,
V(H2)=0.2mol×22.4L/mol=4.48L,
V(CO)=0.1mol×22.4L/mol=2.24L,
故答案为:m(H2)=0.4g,m(CO)=2.8g;V(H2)=4.48L,V(CO)=2.24L.
点评:本题考查混合物的计算,题目难度不大,注意相关物理量的计算公式的运用.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是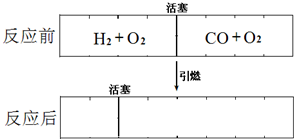 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
