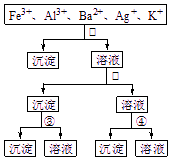题目内容
 用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图示步骤分开五种离子,则溶液①④是( )
用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图示步骤分开五种离子,则溶液①④是( )分析:加入①时,只产生一种沉淀,故①一定是NaCl,沉淀为AgCl;在滤液中加入②后,生成两种沉淀,故②是NH3?H2O或NaOH而生成的沉淀,有一种在③中溶解,故②为NH3?H2O,③为NaOH,则④为H2SO4.
解答:解:从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀.
第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3?H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.
第④步用SO42-将Ba2+和K+分离,
故选B.
第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3?H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.
第④步用SO42-将Ba2+和K+分离,
故选B.
点评:本题考查金属阳离子的定性分析,涉及物质的分离和提纯实验方案的设计,题目难度不大,注意根据物质的性质进行实验设计.

练习册系列答案
相关题目
 用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图示步骤分开五种离子,则溶液①、②、③、④是( )
用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图示步骤分开五种离子,则溶液①、②、③、④是( ) 用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )
用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )