题目内容
下列说法正确的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
C
试题分析:A、HF、HCl、HBr、HI中HF分子间形成氢键,HF沸点最高,错误;B、金属与非金属元素形成的化合物也有可能为共价化合物,如AlCl3,错误;C、N原子与3个Cl分别形成一个共价键,N原子和Cl原子均达到8电子稳定结构,正确;D、NaHSO4晶体中阳离子为Na+,阴离子为HSO4?,个数比为1:1,熔化时只破坏离子键,错误。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
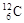 、
、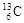 、
、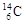 的说法正确的是
的说法正确的是