题目内容
I、恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a=
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n( 始):n(平)=
(4)原混合气体中,a:b=
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=
II、若向体积不变的密闭容器中充入2mol N2和6mol H2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),平衡时混合气共7mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c=
(2)若a=0.7,b=2.1,则:
①c=
②这时反应向
③若要维持反应开始向该反应方向进行,c的范围是
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a=
16
16
.(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量
8mol
8mol
.(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n( 始):n(平)=
5:4
5:4
.(4)原混合气体中,a:b=
2:3
2:3
.(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=
1:2
1:2
.(6)平衡混合气体中,n(N2):n(H2):n(NH3)=
3:3:2
3:3:2
.II、若向体积不变的密闭容器中充入2mol N2和6mol H2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),平衡时混合气共7mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c=
4mol
4mol
.(2)若a=0.7,b=2.1,则:
①c=
2.6
2.6
.②这时反应向
逆反应方向
逆反应方向
进行,因为:浓度商>平衡常数
浓度商>平衡常数
.③若要维持反应开始向该反应方向进行,c的范围是
1<c≤4
1<c≤4
.(3)欲使起始反应维持向与②相反的方向进行,则b的范围是
4.5<b≤6
4.5<b≤6
.分析:I、(1)由N2(g)+3H2(g)?2NH3(g)及氨气的物质的量可计算转化的氮气的物质的量,再由剩余的氮气的可计算a;
(2)由n=
=32mol,NH3的含量(体积分数)为25%来计算;
(3)、(4)、(5)、(6)可利用化学平衡三段法来计算;
II、(1)根据等效平衡及极限转化来计算;
(2)根据N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
转化 x 3x 2x
平衡 2-x 6-3x 2x
2-x+6-3x+2x=7,解得x=0.5,
即平衡时物质的量分别为1.5mol、4.5mol、1mol,结合极限转化、等效平衡、平衡常数等来解答;
(3)根据浓度商与化学平衡常数的关系来分析.
(2)由n=
| 716.8L |
| 22.4L/mol |
(3)、(4)、(5)、(6)可利用化学平衡三段法来计算;
II、(1)根据等效平衡及极限转化来计算;
(2)根据N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
转化 x 3x 2x
平衡 2-x 6-3x 2x
2-x+6-3x+2x=7,解得x=0.5,
即平衡时物质的量分别为1.5mol、4.5mol、1mol,结合极限转化、等效平衡、平衡常数等来解答;
(3)根据浓度商与化学平衡常数的关系来分析.
解答:解:(1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1:2,设转化的N2的物质的量为x mol,
则 x:6=1:2,解之x=3,所以a=13+3=16mol,故答案为:16;
(2)由n=
=32mol,NH3的含量(体积分数)为25%,
n平(NH3)=32 mol×25%=8mol,故答案为:8mol;
(3)N2(g)+3H2(g) 2NH3(g),
2NH3(g),
开始16 b 0
转化4 12 8
平衡12 (32-12-8)8
n( 始):n(平)=(16+24):((12+12+8)=40:32=5:4,故答案为:5:4;
(4)由上述解答可知,b=12+(32-12-8)=24mol,a=16mol,所以a:b=16mol:24mol=2:3,故答案为:2:3;
(5)达到平衡时,N2和H2的转化率之比a(N2):a(H2)=
:0.5=1:2,故答案为:1:2;
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,故答案为:3:3:2;
II、(1)N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
开始 0 0 4
在温度、体积不变的条件下,达到相同的平衡状态,则c=4mol,故答案为:4mol;
(2)①根据N2(g)+3H2(g)?2NH3(g),
开始 0.7 2.1 c
转化 0.5c
将c极限转化为a,即0.5c+0.7=2,解得c=2.6,故答案为:2.6;
②根据N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
转化 x 3x 2x
平衡 2-x 6-3x 2x
2-x+6-3x+2x=7,解得x=0.5,
即平衡时物质的量分别为1.5mol、4.5mol、1mol,
当a、b、c分别为0.7、2.1、2.6时,浓度商>平衡常数(Q>K),则化学反应逆向移动,
故答案为:逆反应方向;(2分);浓度商>平衡常数;
③因平衡时c为1,c的最大值为4,则要维持反应开始向该反应方向进行,应满足1<c≤4,故答案为:1<c≤4;
(3)欲使起始反应维持向与②相反的方向进行,即反应向正向移动,平衡时b=4.5,b的最大值为6,则满足4.5<b≤6即可,
故答案为:4.5<b≤6.
则 x:6=1:2,解之x=3,所以a=13+3=16mol,故答案为:16;
(2)由n=
| 716.8L |
| 22.4L/mol |
n平(NH3)=32 mol×25%=8mol,故答案为:8mol;
(3)N2(g)+3H2(g)
 2NH3(g),
2NH3(g),开始16 b 0
转化4 12 8
平衡12 (32-12-8)8
n( 始):n(平)=(16+24):((12+12+8)=40:32=5:4,故答案为:5:4;
(4)由上述解答可知,b=12+(32-12-8)=24mol,a=16mol,所以a:b=16mol:24mol=2:3,故答案为:2:3;
(5)达到平衡时,N2和H2的转化率之比a(N2):a(H2)=
| 4 |
| 16 |
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,故答案为:3:3:2;
II、(1)N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
开始 0 0 4
在温度、体积不变的条件下,达到相同的平衡状态,则c=4mol,故答案为:4mol;
(2)①根据N2(g)+3H2(g)?2NH3(g),
开始 0.7 2.1 c
转化 0.5c
将c极限转化为a,即0.5c+0.7=2,解得c=2.6,故答案为:2.6;
②根据N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
转化 x 3x 2x
平衡 2-x 6-3x 2x
2-x+6-3x+2x=7,解得x=0.5,
即平衡时物质的量分别为1.5mol、4.5mol、1mol,
当a、b、c分别为0.7、2.1、2.6时,浓度商>平衡常数(Q>K),则化学反应逆向移动,
故答案为:逆反应方向;(2分);浓度商>平衡常数;
③因平衡时c为1,c的最大值为4,则要维持反应开始向该反应方向进行,应满足1<c≤4,故答案为:1<c≤4;
(3)欲使起始反应维持向与②相反的方向进行,即反应向正向移动,平衡时b=4.5,b的最大值为6,则满足4.5<b≤6即可,
故答案为:4.5<b≤6.
点评:本题考查化学平衡的计算,明确三段法计算方法、等效平衡、极性转化、反应方向的判断等知识即可解答,题目难度较大,注意反应的移动方向为学生解答的难点.

练习册系列答案
 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g)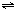 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ. C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
|
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g) C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
针对上述系列试验,下列结论中正确的是______.
A.Ⅰ中a=1
B.实验Ⅳ结果的产生可能是因为采用从生成物配比的方法,且p≥0.98
C.Ⅱ对应的操作方法可以是在Ⅰ的基础上压缩反应容器的体积,且m>0.5
D.将Ⅲ与I比较,可以判断出正反应一定是放热反应.
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
A.Ⅰ中a=1
B.实验Ⅳ结果的产生可能是因为采用从生成物配比的方法,且p≥0.98
C.Ⅱ对应的操作方法可以是在Ⅰ的基础上压缩反应容器的体积,且m>0.5
D.将Ⅲ与I比较,可以判断出正反应一定是放热反应.
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g)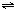 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
针对上述系列试验,下列结论中正确的是( )
A.Ⅰ中a=1
B.实验Ⅳ结果的产生可能是因为采用从生成物配比的方法,且p≥0.98
C.Ⅱ对应的操作方法可以是在Ⅰ的基础上压缩反应容器的体积,且m>0.5
D.将Ⅲ与I比较,可以判断出正反应一定是放热反应
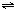 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
A.Ⅰ中a=1
B.实验Ⅳ结果的产生可能是因为采用从生成物配比的方法,且p≥0.98
C.Ⅱ对应的操作方法可以是在Ⅰ的基础上压缩反应容器的体积,且m>0.5
D.将Ⅲ与I比较,可以判断出正反应一定是放热反应
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.