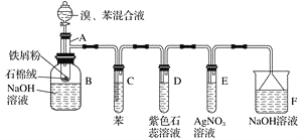
题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族\周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___。
(2)④与⑤两种元素相比较,原子半径较大的是___(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是___(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是___(填化学式),具有两性的化合物是___(填化学式)。
(3)④,⑤,⑥,⑦四种元素形成的简单离子,半径由大到小的顺序为___(填化学式)。
(4)元素①和元素⑦形成化合物属于___化合物(填“离子”或者“共价”)。请用电子式表示⑥和④组成化合物的形成过程:________。
(5)由②和氢元素形成的两种多原子分子,A为10电子结构B为18电子结构,B可由A与次氯酸钠反应制得,该反应的离子方程式为:______________。
【答案】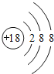 NaHClO4NaOHAl(OH)3S2->Cl->Na+>Al3+共价
NaHClO4NaOHAl(OH)3S2->Cl->Na+>Al3+共价 2NH3+ClO—=N2H4 +Cl—+H2O
2NH3+ClO—=N2H4 +Cl—+H2O
【解析】
由元素在周期表中的位置可以知道,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar。
(1)稀有气体氩原子最外层为稳定结构,化学性质最不活泼,原子结构示意图为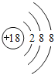 ;
;
(2)④为Na、⑤为Al,两者位于同一周期,核外电子层数相同,Na的核电荷数小,半径大;①为C、②为N、③为O、⑦为Cl,非金属性越强,最高价氧化物所对应的水化物酸性越强,Cl的非金属性最强,所以酸性最强的化合物是HClO4;④为Na、⑤为Al、⑨为K,金属性越强,最高价氧化物对应的水化物的碱性越强,金属性最强的为K,则碱性最强的化合物为KOH;具有两性的化合物是Al(OH)3。
(3)离子的电子层越多,离子半径越多,当电子层相同时,离子的核电荷数越大,离子半径越小,则四种离子的半径大小为:S2->Cl->Na+>Al3+ ;
(4)元素①和⑦形成的化合物为氯化氢,属于共价化合物;元素④与⑥的化合物为Na2S,由钠离子与硫离子构成,其晶体为离子晶体;用Na原子、S原子电子式表示其形成过程为:![]() ;
;
(5)A为10电子结构,所以A为氨气,B为18电子结构所以B为N2H4,B可由A与次氯酸钠反应制得,该反应的离子方程式为2NH3+ClO—=N2H4 +Cl—+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压)取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
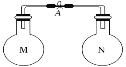
编号 | ① | ② | ③ | ④ |
气体M | HI | NH3 | H2 | NO |
气体N | Cl2 | HCl | N2 | O2 |
A. ①②③④ B. ③①④② C. ④①②③ D. ①④③②