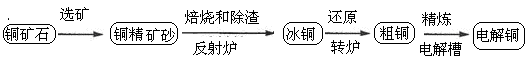
题目内容
为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色。请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应。
①铁锈与稀硫酸反应的化学方程式为__________________________。
②“还发生另一个反应”对应的离子方程式应为______________________________。
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中。
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应。
①铁锈与稀硫酸反应的化学方程式为__________________________。
②“还发生另一个反应”对应的离子方程式应为______________________________。
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中。
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 | __________________ __________________ _________________。 | 乙同学的观点____________ (填“正确”或“错误”)。 |
(1)①Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O(2分)
②Fe + 2Fe3+ = 3Fe2+(2分)
(2)依次滴入适量的氯水和几滴KSCN溶液,振荡(3分)
溶液呈血红色(或溶液颜色无明显变化)(2分) 正确(或错误)(1分)
②Fe + 2Fe3+ = 3Fe2+(2分)
(2)依次滴入适量的氯水和几滴KSCN溶液,振荡(3分)
溶液呈血红色(或溶液颜色无明显变化)(2分) 正确(或错误)(1分)
试题分析:铁锈的主要成分是Fe2O3,它会与稀硫酸反应,方程式为:Fe2O3+3 H2SO4=Fe2(SO4)3+3H2O,生成的Fe3+显黄色,当铁锈反应完后,铁继续与硫酸反应,方程式为:Fe+H2SO4=FeSO4+H2↑,Fe + 2Fe3+ = 3Fe2+,所以会观察到有气泡冒出.因此给生锈金属除锈时不能将生锈的金属放置在酸中太长时间;答案:(1)①Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O(2分)②Fe + 2Fe3+ = 3Fe2+(2分)
⑵取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡,溶液呈血红色(或溶液颜色无明显变化),说明乙同学的观点正确(或错误)。答案:依次滴入适量的氯水和几滴KSCN溶液,振荡(3分) 溶液呈血红色(或溶液颜色无明显变化)(2分) 正确(或错误)(1分)

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目