题目内容
【题目】向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
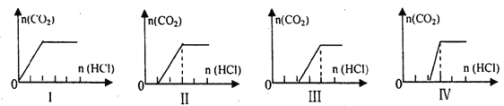
则下列分析都正确的组合是
溶质的成分 | 对应图象 | 溶液中离子浓度关系 | |
A | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)<c(HCO3-) |
B | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
C | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
D | NaHCO3 | I | c(Na+)=c(HCO3-) |
【答案】A
【解析】
试题分析:A、加入盐酸发生反应是:Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,碳酸钠消耗盐酸的体积小于碳酸氢钠消耗盐酸的体积,CO32-的水解程度大于HCO3-,因此c(HCO3-)>c(CO32-),A正确;B、发生的反应是NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,因此氢氧化钠和碳酸钠消耗的盐酸体积大于碳酸氢钠消耗盐酸的体积,无法判断c(OH-)是否大于c(CO32-),B错误;C、Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑,碳酸钠消耗盐酸体积等于碳酸氢钠消耗的盐酸的体积,C错误;D、NaHCO3+HCl=NaCl+H2O+CO2↑,HCO3-水解,c(Na+)>c(HCO3-),D错误。答案选A,

练习册系列答案
 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目