题目内容
下列分子中所有原子不都满足最外层为8个电子结构的是( )
分析:对于共价化合物,元素化合价的绝对值+该元素原子核外电子数=8,该原子满足8电子结构.据此判断.
解答:解:A、PCl3中P元素的化合价为+3,P原子核外电子数为5,所以3+5=8,P原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,Cl原子满足8电子结构,故A不符合;
B、SiCl4中Si元素的化合价为+4,Si原子核外电子数为4,所以4+4=8,Si原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,Cl原子满足8电子结构,故B不符合;
C、CS2中C元素的化合价为+4,C原子核外电子数为4,所以4+4=8,C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,O原子满足8电子结构,故C不符合;
D、BF3中B元素的化合价为+3,B原子核外电子数为3,所以3+3=6,B原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+7=8,F原子满足8电子结构,故D符合.
故选:D.
B、SiCl4中Si元素的化合价为+4,Si原子核外电子数为4,所以4+4=8,Si原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以|-1|+7=8,Cl原子满足8电子结构,故B不符合;
C、CS2中C元素的化合价为+4,C原子核外电子数为4,所以4+4=8,C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,O原子满足8电子结构,故C不符合;
D、BF3中B元素的化合价为+3,B原子核外电子数为3,所以3+3=6,B原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+7=8,F原子满足8电子结构,故D符合.
故选:D.
点评:考查分子结构与共价键等,难度不大,清楚元素化合价的绝对值+该元素原子核外电子数=8,该原子原子满足8电子结构是关键.

练习册系列答案
相关题目
下列分子中所有原子不可能共平面的是( )
A、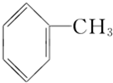 | B、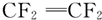 | C、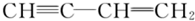 | D、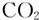 |