题目内容
用8.7 g MnO2和10 mol·L-1的盐酸120 mL反应制取Cl2。
(1)在标准状况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1 L后,取出20 mL(不考虑HCl损失),在这20 mL溶液中加入足量AgNO3溶液,可得AgCl多少克?
(1)2.24 L。 (2)2.87 g。
[解析] (1)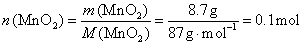 ,n (HCl)=10 mol·L-1×0.12 L=1.2 mol。
,n (HCl)=10 mol·L-1×0.12 L=1.2 mol。
MnO2 + 4HCl (浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4
0.1 mol 1.2 mol
盐酸过量,依MnO2的量来计算。n (Cl2)=n (MnO2)=0.1 mol,故V (Cl2)=0.1 mol×22.4 L·mol―1=2.24 L。
(2)由(1)可知n (Cl2)=0.1 mol,根据氯元素守恒,有:
n (Cl―)=n (HCl)―2n (Cl2)=1.2 mol―2×0.1 mol=1 mol。
在20 mL溶液中,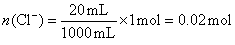 。
。
依Cl―~AgCl,有:n (AgCl)=n (Cl―)=0.02 mol。
故m (AgCl)=0.02 mol×143.5 g·mol-1=2.87 g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2NH3(g)的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( )
2NH3(g)的正、逆反应速度可用各反应物或生成物浓度变化来表示。下列各关系中能说明反应已经达到化学平衡的是 ( ) +OH
+OH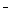 ==CO
==CO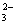 +H2O
+H2O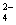 +Ba2+ + 2OH
+Ba2+ + 2OH