��Ŀ����
��������Ľ���֮һ��
��1��Ũ���ᡢŨ���������������������ԭ���� ��
��2����������ҪӦ���ڻ���ƽ�������ҵ��������ˮ�Ȼ������⻯��ﮣ�LiAlH4�����л��ܼ��з�Ӧ�Ƶ�����������ѧ����ʽ���£�3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2��
�÷�Ӧ��������Ϊ ��
��3���⻯���ƣ�NaAlH4����һ����Ҫ�Ĵ�����ϣ���֪��
NaAlH4(s)=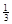 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ��H��+ 37 kJ��mol��1
Al (s) + H2(g) ��H��+ 37 kJ��mol��1
Na3AlH6(s)="3NaH(s)+"
Al (s) +  H2(g) ��H��+ 70.5 kJ��mol��1
H2(g) ��H��+ 70.5 kJ��mol��1
��NaAlH4(s)="
NaH(s)" + Al (s) + H2(g) ��H�� ��
H2(g) ��H�� ��

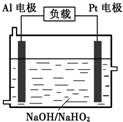
��4����֪H2O2��һ�����ᣬ��ǿ������Һ����Ҫ��HO2����ʽ���ڡ�Ŀǰ�о��Ƚ����ŵ�Al��H2O2ȼ�ϵ�أ���ԭ������ͼ��ʾ������ܷ�Ӧ���£�
2Al+3HO2��+3H2O =2[Al(OH) 4]��+OH��
��������ӦʽΪ ��
������ͨп�̸ɵ����ȣ���������ͬ�����ĸ�����������ʱ��Al��H2O2ȼ�ϵ�ص����۷ŵ���ԼΪ��ͨп�̸ɵ�ص�______����
��Al�缫�ױ�NaOH��Һ��ѧ��ʴ�����Ǹõ��Ŀǰδ���ƹ�ʹ�õ�ԭ��֮һ����Ӧ�����ӷ���ʽΪ ��
��9�֣���1�������£����ױ�Ũ���ᡢŨ����ۻ�
��2��LiAlH4��AlCl3 ��3��+ 60.5 kJ��mol��1
��4���� 3HO2��+3H2O+6e��=9OH������HO2��+H2O+2e��=3OH����
�� 3.6 ��2�֣� �� 2Al+6H2O+2OH��=2[Al(OH) 4]��+3H2��
��������
�����������1�������£����ױ�Ũ���ᡢŨ����ۻ�������Ũ���ᡢŨ��������������������С�
��2�����ݷ�Ӧ�ķ���ʽ��֪����Ԫ�صĻ��ϼ۴ӣ�3�۽��͵�0�ۣ��õ����ӣ�������ԭ��Ӧ��������������LiAlH4��AlCl3 ��
��3�����ݸ�˹���ɿ�֪���٣��ڡ�1/3�����õ���ӦʽNaAlH4(s)=" NaH(s)" + Al (s) +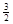 H2(g)�����Ը÷�Ӧ�ġ�H����37 kJ/mol��70.5 kJ/mol��3��60.5 kJ/mol.
H2(g)�����Ը÷�Ӧ�ġ�H����37 kJ/mol��70.5 kJ/mol��3��60.5 kJ/mol.
��4����ԭ����������õ����ӣ�������ܵķ�Ӧʽ��֪Alʧȥ���ӣ�������������������Ӧʽ��3HO2��+3H2O+6e��=9OH������HO2��+H2O+2e��=3OH������
����ͨп�̸ɵ���и�����п��65gпʧȥ2mol���ӣ���65g��ʧȥ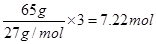 ���ӣ�����Al��H2O2ȼ�ϵ�ص����۷ŵ���ԼΪ��ͨп�̸ɵ�ص�7.22��2��3.6����
���ӣ�����Al��H2O2ȼ�ϵ�ص����۷ŵ���ԼΪ��ͨп�̸ɵ�ص�7.22��2��3.6����
�����ܺ�����������Һ��Ӧ����ƫ�����ƺ���������Ӧ�����ӷ���ʽ��2Al+6H2O+2OH��=2[Al(OH) 4]��+3H2����
���㣺�����������ʡ���;����Ӧ�ȵļ��㡢�缫��Ӧʽ����д�Լ��йؼ���
�������������е��Ѷȵ����⣬���������ӱ��������ǿ�������ڵ���ѧ����ѧϰ��Ȥ��ѧϰ�����ԣ�����ѧ����ѧϰ��֪����Ҳ����������ѧ���Ĺ淶�������������������������ѧ����ѧϰЧ�ʡ�

 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ��H��+ 37 kJ��mol��1
Al (s) + H2(g) ��H��+ 37 kJ��mol��1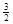 H2(g) ��H��+ 70.5 kJ��mol��1
H2(g) ��H��+ 70.5 kJ��mol��1
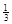 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ��H��+ 37 kJ��mol��1
Al (s) + H2(g) ��H��+ 37 kJ��mol��1 H2(g) ��H��+ 70.5 kJ��mol��1
H2(g) ��H��+ 70.5 kJ��mol��1

