题目内容
【题目】太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2![]() LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A.放电时镍被还原 B.放电时负极LaNi5H+OH——e—=LaNi5+H2O
C.充电时OH—向阴极移动 D.充电时每消耗lmol Ni(OH)2转移lmol电子
【答案】C
【解析】
试题分析:A.根据该太阳能电池放电时的反应原理可知:在放电时LaNi5→LaNi5H,化合价降低,得到电子被还原。正确。B.放电时负极LaNi5H+OH——e—=LaNi5+H2O。正确。C.充电时根据同种电荷相互排斥,异种电荷相互吸引的原则,OH—向阳极移动。错误。D.根据氧化还原反应中化合价升高或降低的总数与电子转移数目相等可得:若充电时每消耗lmol Ni(OH)2转移lmol电子。正确。

【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
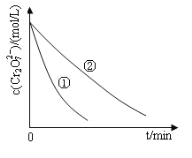
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
A.A
B.B
C.C
D.D