题目内容
硫——碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2=H2SO4+2HI II 2HI ![]() H2+I2 III 2H2SO4=2SO2+O2+2H2O
H2+I2 III 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
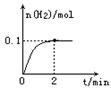 (2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
0—2min内的平均反应速率v(HI)= ;
该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b. HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
A.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(1)c (2)0.1mol/(L·min) 64 b (3)向右 b(各2分)

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2010?山东)硫一碘循环分解水制氢主要涉及下列反应:
(2010?山东)硫一碘循环分解水制氢主要涉及下列反应: H2+I2
H2+I2 2HI(g)的平衡常数K=
2HI(g)的平衡常数K= 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:












 H2+I2(g)
H2+I2(g) 