题目内容
【题目】瑞典 ![]() 公司设计的用于驱动潜艇的液氨-液氧燃料电池如图所示,下列有关说法正确的是( )
公司设计的用于驱动潜艇的液氨-液氧燃料电池如图所示,下列有关说法正确的是( )
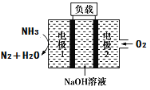
A. 电池工作时,电极2上发生氧化反应
B. 电池工作一段时间后停止,溶液 pH比开始时明显增大
C. 电极1发生的电极反应为2NH3 + 6OH--6e-= N2↑ + 6H2O
D. 用该电池做电源电解精炼铜,理论上每消0.2molNH3的同时阳极会得到 19.2g纯铜
【答案】C
【解析】原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,氨气在负极通入,氧气在正极通入,结合原电池的工作原理解答。
A.电极1通入氨气,为负极,电极2通入氧气为正极,发生得到电子的还原反应,A错误;
B.电池总方程式为4NH3+3O2=2N2+6H2O,生成水,溶液体积增大,氢氧根浓度减小,pH减小,B错误;
C.在燃料电池的负极上发生燃料氨气失电子的氧化反应,则碱性环境下电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O,C正确;
D.由2NH3+6OH--6e-=N2↑+6H2O可知,理论上每消耗0.2 molNH3,可转移0.6mol电子,阳极发生氧化反应,不能得到铜,D错误;
答案选C。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目