题目内容
(1)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能否设计成原电池 .
②如果不能,说明其原因 .
(2)选择适宜的材料和试剂设计一个原电池,以便完成下列反应.
Zn+CuSO4=ZnSO4+Cu
①写出电极反应式;
②画出装置图并标明名称. .
①根据两反应本质,判断能否设计成原电池
②如果不能,说明其原因
(2)选择适宜的材料和试剂设计一个原电池,以便完成下列反应.
Zn+CuSO4=ZnSO4+Cu
①写出电极反应式;
②画出装置图并标明名称.
分析:(1)①设计成原电池的依据是自发进行的氧化还原反应分析;
②费氧化还原反应不能设计成原电池;
(2)①依据化学方程式中元素化合价变化,分析,原电池中锌做负极是电子发生氧化反应,溶液中铜离子得到电子在正极发生还原反应;
②依据原电池原理分析绘制装置图.
②费氧化还原反应不能设计成原电池;
(2)①依据化学方程式中元素化合价变化,分析,原电池中锌做负极是电子发生氧化反应,溶液中铜离子得到电子在正极发生还原反应;
②依据原电池原理分析绘制装置图.
解答:解:(1)①(A)NaOH+HCl=NaCl+H2O,反应是复分解反应,不是氧化还原反应,不能产生电子转移,不能设计原电池;
(B)2FeCl3+Cu=2FeCl2+CuCl2,是自发进行的氧化还原反应,有电子转移,可以设计成原电池,
故答案为:(A)不能,(B)可以;
②NaOH+HCl=NaCl+H2O,反应是复分解反应,不是氧化还原反应,没有电子转移,不能设计成原电池,
故答案为:(A)的反应是非氧化还原反应,没有电子转移;
(2)①Zn+CuSO4=ZnSO4+Cu,反应是自发进行的氧化还原反应,锌失电子发生氧化反应,做原电池的负极,电极反应为Zn-2e-=Zn2+,溶液中的铜离子在正极得到电子发生还原反应,正极电极反应为Cu2++2e-=Cu,
故答案为:负极为Zn-2e-=Zn2+,正极为Cu2++2e-=Cu;
②锌做负极,铜做正极,电解质溶液为硫酸铜溶液,标明电极材料名称即锌片与铜片、电解液为CuSO4溶液,装置图为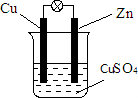 ,
,
故答案为: .
.
(B)2FeCl3+Cu=2FeCl2+CuCl2,是自发进行的氧化还原反应,有电子转移,可以设计成原电池,
故答案为:(A)不能,(B)可以;
②NaOH+HCl=NaCl+H2O,反应是复分解反应,不是氧化还原反应,没有电子转移,不能设计成原电池,
故答案为:(A)的反应是非氧化还原反应,没有电子转移;
(2)①Zn+CuSO4=ZnSO4+Cu,反应是自发进行的氧化还原反应,锌失电子发生氧化反应,做原电池的负极,电极反应为Zn-2e-=Zn2+,溶液中的铜离子在正极得到电子发生还原反应,正极电极反应为Cu2++2e-=Cu,
故答案为:负极为Zn-2e-=Zn2+,正极为Cu2++2e-=Cu;
②锌做负极,铜做正极,电解质溶液为硫酸铜溶液,标明电极材料名称即锌片与铜片、电解液为CuSO4溶液,装置图为
 ,
,故答案为:
 .
.点评:本题考查了原电池原理的分析应用,电极名称,电极反应,电极判断是解题关键,原电池设计的实质是自发进行的氧化还原反应,题目较简单.

练习册系列答案
相关题目