题目内容
15.将11g铝铁合金的粉末放入100mL过量的KOH溶液中充分反应,得到标准状况下6.72L H2.试计算:(1)该合金中铝的质量分数(保留两位有效数字);
(2)该合金中铝和铁的物质的量之比.
分析 (1)铝与氢氧化钠溶液反应的方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,利用生成的氢气体积根据方程式计算Al的物质的量,再根据m=nM计算出铝的质量,进而该合金中铝的质量分数;
(2)根据合金中金属铝的质量计算金属镁的质量,得出二者的物质的量之比即可.
解答 解:(1)合金与碱反应生成的气体的物质的量为n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
n(Al) 0.3mol
所以,n(Al)=$\frac{0.3mol×2}{3}$=0.2mol,
故m(Al)=0.2mol×27g/mol=5.4g,该合金中铝的质量分数=$\frac{5.4g}{11g}$×100%≈49%,
答:合金中铝的质量分数是49%;
(2)该合金中铝的质量为5.4g,物质的量是0.2mol,Fe的质量是5.6g,物质的量是0.1mol,所以合金中铝和铁的物质的量之比是2:1,
答:合金中铝和铁的物质的量之比是2:1.
点评 本题考查混合物的计算、铝和铁的化学性质,题目难度中等,明确金属铝既能与酸又能与碱反应、而铁只能与酸反应是解本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.以下实验操作可能会导致实验结果偏高的是( )
| A. | 配制一定物质的量浓度的溶液:称量固体时物体与砝码位置颠倒 | |
| B. | 配制一定物质的量浓度的溶液:定容时仰视刻度线 | |
| C. | 用浓硫酸与烧碱的稀溶液反应来测定中和热的数值 | |
| D. | 用10.0mL的量筒量取7.8mL浓硫酸时俯视读数 |
6.如表用品所对应的有效成分和用途有错误的是( )
| A | B | C | D | |
| 用品 | 食盐 | 小苏打 | 明矾 | 漂白粉 |
| 有效成分 | NaCl | NaHCO3 | KAl(SO4)2•12H2O | CaCl2 |
| 用途 | 做调味品 | 做发酵粉 | 做净水剂 | 做消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
3.“空气质量日报”中一般不列入的是( )
| A. | 二氧化碳 | B. | 二氧化氮 | C. | 二氧化碳 | D. | 可吸入颗粒物 |
10.当光束通过下列物质时,能观察到丁达尔效应的是( )
①尘埃的空气 ②酒精 ③墨水 ④稀豆浆 ⑤硫酸铜溶液.
①尘埃的空气 ②酒精 ③墨水 ④稀豆浆 ⑤硫酸铜溶液.
| A. | ①②④ | B. | ①③⑤ | C. | ①③④ | D. | ②③④ |
7.下列说法错误的是( )
| A. | 蒸馏可用于分离提纯液态有机混合物 | |
| B. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 | |
| C. | 核磁共振氢谱通常用于分析有机物的相对分子质量 | |
| D. | 甲烷和氯气发生取代反应需要光照 |
4.对于如图的叙述错误的是( )


| A. | 图示实验中发生了化学变化 | |
| B. | 液体X溶液的pH>7,液体Y是一种黑色黏稠状液体 | |
| C. | 气体Z易燃,可还原CuO,也可使溴水褪色 | |
| D. | 试管A中产生浓的白烟 |
5.卤族元素的单质和化合物很多我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)已知高碘酸有两种形式,化学式分别为H5IO6(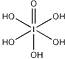 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.