题目内容
20.写出下列物质在水溶液中的电离方程式(1)CH3COOHCH3COOH?CH3COO-+H+
(2)NaHSO4NaHSO4=Na++H++SO42-.
分析 (1)醋酸为弱电解质,在溶液中部分电离出醋酸根离子和氢离子,电离方程式用可逆号;
(2)硫酸氢钠为强电解质,在溶液中完全电离出钠离子、氢离子和硫酸根离子.
解答 解:(1)醋酸在溶液中部分电离,其电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
(2)硫酸氢钠在溶液中完全电离,其电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查了电离方程式的书写,题目难度中等,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的判断方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
11.某有机物A(C8H16O2)能发生如图所示的变化,其中C与F是同分异构体.则符合该条件的A的同分异构体有( )
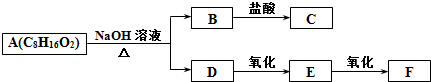

| A. | 1种 | B. | 2种 | C. | 4种 | D. | 16种 |
8.下列物质中,可以用来鉴别乙醇溶液、苯和乙酸溶液三种无色液体的是( )
| A. | 水 | B. | 碳酸钠溶液 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
12.自然界中存在的元素大多以化合态存在,而我们在生产、生活中需要许多单质,如Fe、Si等.若元素由化合态变成游离态,则它( )
| A. | 被氧化 | B. | 被还原 | ||
| C. | 由高价态变为零价 | D. | 可能被氧化也可能被还原 |
9.高温条件下反应达到平衡时的平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容条件下升高温度,H2浓度减小.则下列说法正确的是( )
| A. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$?_{高温高压}^{催化剂}$CO2(g)+H2(g)△H<0 kJ/mol | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的正反应为放热反应 |
10.对化学反应3X(g)+Y(g)?2Z(g)+2Q(s)达到平衡后,增大压强,下列关于对该化学反应产生的影响的说法正确的是( )
| A. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都没有变化,平衡不发生移动 |