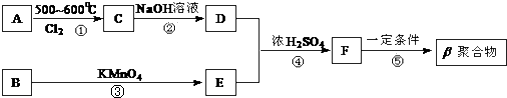
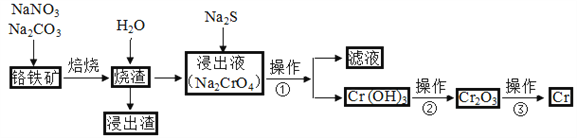
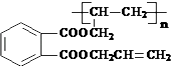题目内容
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A.3.4gNH3中含有电子数为2NA
B.0.1mol/L CuSO4溶液中含有的SO ![]() 数目为0.1NA
数目为0.1NA
C.常温常压下,2.24L O3中含有的氧原子数为0.3NA
D.足量的MnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的分子数为0.1NA
【答案】A
【解析】解:A.n(NH3)= ![]() =0.2mol,含有的电子的物质的量为0.2mol×10=2mol,则个数为2NA , 故A正确; B.溶液体积未知,无法计算微粒个数,故B错误;
=0.2mol,含有的电子的物质的量为0.2mol×10=2mol,则个数为2NA , 故A正确; B.溶液体积未知,无法计算微粒个数,故B错误;
C.常温常压,Vm≠22.4L/mol,无法计算氧气的物质的量,故C错误;
D.足量的MnO2与50mL 8mol/L浓盐酸充分反应后,理论上生成0.1mol氯气,但是随着反应进行,盐酸浓度降低,稀盐酸与二氧化锰不反应,生成氯气小于0.1mol,故D错误;
故选:A.

练习册系列答案
相关题目