题目内容
下列实验现象的叙述,正确的是
| A.钠在氧气中燃烧,火焰呈黄色,产生白色固体 |
| B.氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 |
| C.钠投入水中,将沉在水底并熔化成小球、且有气泡产生 |
| D.氯气通入紫色石蕊试液中,溶液先变红后褪色 |
D
解析试题分析:A.钠在氧气中燃烧,火焰呈黄色,产生淡黄色固体Na2O2.错误。B.氢气在氯气中燃烧,发出苍白色火焰,同时在集气瓶口上方有白雾。错误。C.钠投入水中,由于Na的密度比水小,所以浮在水面上。二者发生反应放出热量使Na熔化成小球,放出氢气逸出有气泡产生。错误。D.氯气通入紫色石蕊试液中发生反应Cl2+H2O HCl+HClO,HCl、HClO都是酸,使溶液显酸性,所以紫色石蕊溶液变红。但由于HClO有漂白性,因此溶液后褪色。正确。
HCl+HClO,HCl、HClO都是酸,使溶液显酸性,所以紫色石蕊溶液变红。但由于HClO有漂白性,因此溶液后褪色。正确。
考点:考查常见的实验现象的叙述与反应原理的知识。

练习册系列答案
相关题目
某化学兴趣小组对废铁屑做如图所示的处理。相关分析正确的是: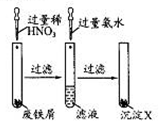
| A.滤液的溶质是Fe(NO3)2 |
| B.该实验中发生的反应都为氧化还原反应 |
| C.沉淀X为Fe(OH)2 |
| D.沉淀X受热分解得到Fe2O3 |
要测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数可采取不同的方法,取a克样品与一定量稀盐酸(过量)充分反应后,下列说法正确的是
| A.逸出气体若用碱石灰吸收,增重b克。则测定混合物中Na2CO3的质量分数偏小 |
| B.把所得溶液加热蒸干,并灼烧至恒重,得b克固体。蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C.某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D.产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是 ( )。
| 选项 | 实验 | 现象 | 解释或结论 |
| A | 加入FeCl3固体 | 溶液变成红褐色 | FeCl3的水解程度变大 |
| B | 加入等体积水 | 溶液颜色变浅 | c(Fe3+)变小 |
| C | 加入足量Fe粉 | 溶液颜色变成浅绿色 | 2Fe3++Fe=3Fe2+ |
| D | 将FeCl3溶液微热 | 溶液变成红褐色 | 水解反应ΔH>0 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存
在,下列判断不正确的是( )
| A.加入KSCN溶液一定不变红色 |
| B.溶液中一定含Fe2+ |
| C.溶液中一定含Cu2+ |
| D.剩余固体中一定含铜 |
根据以下叙述制备氯化铜:先将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
在除去溶液中的Fe2+时,可采用的方法是( )
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
下列反应所得溶液中一定只含一种溶质的是( )
| A.向AlCl3溶液中滴入NaOH溶液 |
| B.向NaOH溶液中通入SO2气体 |
| C.向稀硝酸中加入过量铁粉 |
| D.向Na2CO3溶液中滴入盐酸 |
CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
( )
| A.Cs显+3价,I、Cl均显-1价 |
| B.Cs显+1价,Cl显+1价,I显-1价 |
| C.在CsICl2溶液中通入Cl2,有单质碘生成 |
| D.在CsICl2溶液中通入SO2气体,有硫酸生成 |
我国古代的湿法冶金术是世界闻名的。我国在世界上最先应用湿法冶金术冶炼出来的金属是( )。
| A.Fe | B.Cu | C.Ag | D.Hg |