��Ŀ����
�������ӷ���ʽ����д�������������������
A. ��Cl2ͨ������������Һ��ȡ����Һ��Cl2��2OH- ��Cl����ClO-+H2O
B. ��֪�����ᣨH2SO3���Ķ������볣��K2��ƫ���ᣨHAlO2���ĵ��볣��KҪ����������SO2����ͨ�뵽ƫ��������Һ�з��������ӷ�Ӧ�ǣ�2AlO2���� SO2��3 H2O ��2Al(OH)3����SO32-
C. ��������Һ�м�������������Һ�������������ﵽ���ʱ���������ӷ�Ӧ�ǣ�
2Al3+ ��3SO42����3Ba2+��6OH���� 3BaSO4����2 Al(OH)3��
D. �������Ը�����ز�����м�ȩ������ӦΪ��4MnO4- + 5HCHO +12H+= 4Mn2+ + 5CO2�� +11H2O
��.�����£���ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ�������ϣ�������Һ�����ʵ�����Ũ�Ⱥͻ��Һ��pH���±���ʾ��
ʵ���� | HA�����ʵ���Ũ��(mol��L-1) | NaOH�����ʵ���Ũ��(mol��L-1) | ��Ϻ���Һ��pH |
�� | 0.1 | 0.1 | pH��a |
�� | 0.12 | 0.1 | pH��7 |
�� | 0.2 | 0.1 | pH��7 |
�� | 0.1 | 0.1 | pH��10 |
��1���Ӽ����������������ж�HA��ǿ�ỹ��� ��
��2����������Һ������Ũ��c(A-)��c(Na+)�Ĵ�С��ϵ�� ��
A��ǰ�ߴ� B�����ߴ� C��������� D�����ж�
��3���ӱ���ʵ�����������û����Һ������Ũ���ɴ�С��˳���� ��
��4����������ʵ�����ݣ�д���û����Һ��������ʽ�ľ�ȷ���(��ʽ)��c(Na+)��c(A-)�� mol/L��
��.ij��Ԫ��(����ʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2B=H++HB-��HB-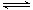 H++B2-
H++B2-
�ش��������⣺
��5����0.1 mol/L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ���� ��
A��c(B2-)+c(HB-)��0.1mol/L
B��c(B2-)+c(HB-)+c(H2B)��0.1mol/L
C��c(OH-)��c(H+)+c(HB-)
D��c(Na+)+c(OH-)��c(H+)+c(HB��)


 2HF(g) ��H>0����ƽ����ϵ��������m(��)�������ʵ���n(��)֮���ڲ�ͬ�¶�����ѹǿ�ı仯������ͼ��ʾ������˵����ȷ����
2HF(g) ��H>0����ƽ����ϵ��������m(��)�������ʵ���n(��)֮���ڲ�ͬ�¶�����ѹǿ�ı仯������ͼ��ʾ������˵����ȷ����
 =30g��mol-1ʱ��n(HF):n[(HF)2]��2:1
=30g��mol-1ʱ��n(HF):n[(HF)2]��2:1 �յ������ֱ�Ϊ160kJ��330kJ����S(s)��3F2(g)��SF6(g)�ķ�Ӧ�Ȧ�HΪ
�յ������ֱ�Ϊ160kJ��330kJ����S(s)��3F2(g)��SF6(g)�ķ�Ӧ�Ȧ�HΪ
