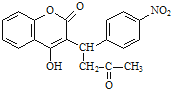
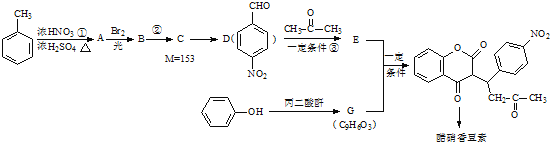
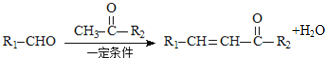题目内容
【题目】某溶液中Cl-、Br-、I-的物质的量之比是2:3:4,要使溶液中的Cl-、Br-、I-的物质的量之比为4:3:2,则通入氯气的物质的量是原溶液I-的物质的量的( )
A. 1∕2 B. 1∕4 C. 1∕6 D. 1∕8
【答案】B
【解析】试题分析:还原性:I->Br->Cl-,通入一定量的Cl2,Cl-、Br-、I-三者物质的量之比由2:3:4变为1:1:1,说明溶液还有剩余的I-,则溶液中的Br-不反应,设开始Cl-、Br-、I-三者物质的量分别是2mol、3mol、4mol,则反应后分别为4mol、3mol、2mol,则Cl-增加4mol-2mol=2mol,由方程式2I-+Cl2=I2+2Cl-可知参加反应的Cl2为:2mol×![]() =1mol,所以通入Cl2的物质的量是原溶液中I-物质的量之比为:
=1mol,所以通入Cl2的物质的量是原溶液中I-物质的量之比为:![]() ,故选项B正确。
,故选项B正确。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目