题目内容
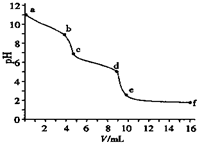 (2013?厦门二模)用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知饱和CO2溶液pH为5.6),下列说法正确的是( )
(2013?厦门二模)用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知饱和CO2溶液pH为5.6),下列说法正确的是( )分析:A、根据滴定之前溶液的pH来计算碳酸钠的浓度;
B、在pH=6时,溶液显酸性,根据溶液的组成情况确定离子浓度的大小关系;
C、根据电荷守恒以及溶液显示中性时氢离子和氢氧根离子浓度相等来判断;
D、根据pH变化图象结合滴定实际来回答.
B、在pH=6时,溶液显酸性,根据溶液的组成情况确定离子浓度的大小关系;
C、根据电荷守恒以及溶液显示中性时氢离子和氢氧根离子浓度相等来判断;
D、根据pH变化图象结合滴定实际来回答.
解答:解:A、滴定之前碳酸钠溶液的pH=11,所以溶液中氢氧根离子的浓度为0.001 mol?L-1,该Na2CO3溶液的浓度大于0.001 mol?L-1,故A错误;
B、在pH=6时,溶液显酸性,溶液的组成可能是:碳酸氢钠和饱和二氧化碳溶液的混合物,此时c(Na+)>c(HCO3-)>c(CO32-),故B正确;
C、在pH=7时,溶液显示中性,氢离子和氢氧根离子浓度相等,此时溶液中还含有碳酸根离子和碳酸氢根离子,所以钠离子大于氯离子浓度,故C错误;
D、根据pH变化曲线,可以看出c到d阶段,随着盐酸的加入,pH不再变化,所以该阶段盐酸剩余,碳酸钠和碳酸氢钠完全消耗掉了,故D错误.
故选B.
B、在pH=6时,溶液显酸性,溶液的组成可能是:碳酸氢钠和饱和二氧化碳溶液的混合物,此时c(Na+)>c(HCO3-)>c(CO32-),故B正确;
C、在pH=7时,溶液显示中性,氢离子和氢氧根离子浓度相等,此时溶液中还含有碳酸根离子和碳酸氢根离子,所以钠离子大于氯离子浓度,故C错误;
D、根据pH变化曲线,可以看出c到d阶段,随着盐酸的加入,pH不再变化,所以该阶段盐酸剩余,碳酸钠和碳酸氢钠完全消耗掉了,故D错误.
故选B.
点评:本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目