题目内容
11.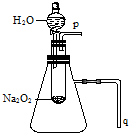 实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二,反应放出热量.Na2O2跟水反应的化学方程式是2Na2O2+2H2O═4NaOH+O2↑.
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论.用以验证第一条结论的实验方法是:P处用带火星的木条靠近木条复燃;用以验证第二条结论的实验方法是:Q导管放入盛水的水槽中有气泡产生.
分析 (1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,说明过氧化钠与水反应放出热量,结合质量守恒定律可知生成NaOH和氧气;
(2)用A图所示装置进行实验,生成氧气具有助燃性,放热使锥形瓶内气体碰撞.
解答 解:(1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,可知反应生成氧气,且反应放出热量,发生的反应为2Na2O2+2H2O═4NaOH+O2↑,
故答案为:反应放出热量;2Na2O2+2H2O═4NaOH+O2↑;
(2)用A图所示装置进行实验,验证第一条结论的实验方法是P处用带火星的木条靠近木条复燃;用以验证第二条结论的实验方法是Q导管放入盛水的水槽中有气泡产生,
故答案为:P处用带火星的木条靠近木条复燃;Q导管放入盛水的水槽中有气泡产生.
点评 本题考查实验装置的综合及过氧化钠的性质,为高频考点,把握发生的反应、反应特点及物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列有关物质的使用叙述不合理的是( )
| A. | 亚硝酸钠是常用的防腐剂 | |
| B. | 婴儿食品可添加着色剂,以增加婴儿对食物的兴趣 | |
| C. | 食用盐既可以做防腐剂,又可以做调味剂 | |
| D. | 药物可以帮助我们战胜疾病,但我们仍需合理用药 |
19.乙烯在含有少量SO2、CO2及水蒸气,用下列5中试剂检验这四种气体,混合物通过试剂的顺序依次是( )
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
| A. | ④⑤①②③ | B. | ④⑤①③② | C. | ⑤①③②④ | D. | ④③①⑤② |
6.某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色.”
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想Ⅰ:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-( 填离子方程式)所致.
猜想Ⅱ:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-( 填离子方程式)所致.
(2)设计实验并验证:
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
所给试剂:酚酞试液、CCl4、无水酒精、KSCN溶液
方案1:取所述黄色溶液于试管中,滴加KSCN并振荡,溶液变红色;则溶液变黄色由反应①所致.
方案2:取所述黄色溶液于试管中,滴加CCl4并振荡;实验现象为CCl4层(下层)无色.
(3)实验结论:
以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-
强(填“强”或“弱”).
(4)实验反思:
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上下层均为黄色.
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况下),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
| 『资料』 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色. |
(1)提出问题猜想:
猜想Ⅰ:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-( 填离子方程式)所致.
猜想Ⅱ:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-( 填离子方程式)所致.
(2)设计实验并验证:
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
所给试剂:酚酞试液、CCl4、无水酒精、KSCN溶液
方案1:取所述黄色溶液于试管中,滴加KSCN并振荡,溶液变红色;则溶液变黄色由反应①所致.
方案2:取所述黄色溶液于试管中,滴加CCl4并振荡;实验现象为CCl4层(下层)无色.
(3)实验结论:
以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-
强(填“强”或“弱”).
(4)实验反思:
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上下层均为黄色.
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况下),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
3.在实验室进行下列实验,不使用水浴加热的是( )
| A. | 苯的硝化反应 | B. | 乙酸乙酯水解 | C. | 乙醛与Cu(OH)2反应 | D. | 醛的银镜反应 |
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.

 ;
;