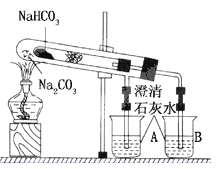
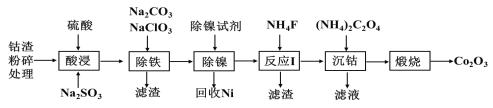
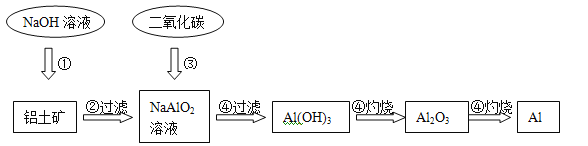
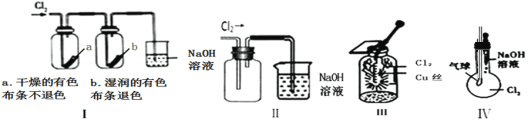
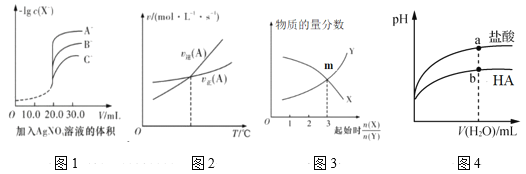
题目内容
【题目】常温下向20 mL浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中逐滴加入0.1mol·L-1的Ba(OH)2溶液。充分反应后静置,Ba(OH)2溶液体积与溶液的pH的关系如下图,下列说法正确的是(假设过程中生成的NH3·H2O不分解)
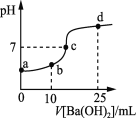
A.a点溶液中:c(NH4+)+c(NH3·H2O)=0.4 mol·L-1
B.b点溶液中:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)
C.c点溶液中:c(Ba2+) + c(NH4+)=c(SO42-)
D.d点溶液中:c(NH3·H2O)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)
【答案】B
【解析】
A、a点溶液是NH4HSO4 、(NH4)2SO4混合溶液,存在物料守恒:c(NH4+)+c(NH3·H2O)=0.3 mol·L-1,故A错误;
B、b点溶液是向20 mL 浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中滴加10mL0.1mol·L-1的Ba(OH)2溶液,则氢离子和氢氧根离子反应完全,铵根离子0.06mol没反应,硫酸根被沉淀了0.01mol,剩余硫酸根是0.03mol,则c(NH4+)>c(SO42-)>c(H+),故B正确;
C、c点溶液是向20 mL 浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中滴加Ba(OH)2溶液,溶液显示中性的时候c(OH-)=c(H+),根据电荷守恒2c(Ba2+) +c(H+)+c(NH4+)=2c(SO42-)+ c(OH-),得到2c(Ba2+) +c(NH4+)=2c(SO42-),故C错误;
D、d点溶液是向20 mL 浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中滴加25mL0.1mol/L的Ba(OH)2溶液,则溶液中产生了0.03molNH3H2O,剩余NH4+0.03mol,剩余SO42-0.015mol,由于溶液呈碱性,电离大于水解,所以c(NH4+)>c(NH3·H2O)>c(SO42-)> c(OH-)>c(H+),故D错误;
故答案B。