题目内容
【题目】根据题意解答
(1)某温度下,Kw=10﹣12 . 若保持温度不变,向少量水中加入g的NaOH固体,并加水稀释至1L,才能使溶液中水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣26 . 若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH﹣)=1010 , 则此时水电离的c(OH﹣)=molL﹣1 .
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸 三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是 . (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 . (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 . (用a、b、c表示)
(3)现有两瓶pH=2的盐酸和醋酸溶液,简述如何用最简单的方法区别盐酸和醋酸.(限选试剂:石蕊试液、酚酞试液、pH试纸、蒸馏水).采用的方法为 .
(4)执信中学A学生为了测定某烧碱样品的纯度,准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.用0.200 0molL﹣1的标准盐酸进行滴定,选择甲基橙作指示剂,试根据实验回答下列问题:
①滴定过程中,眼睛应注视;滴定终点时,溶液从色变为色, .
②观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果(填“偏高”、“偏低”或“无影响”);若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果(填“偏高”、“偏低”或“无影响”).
③根据如表数据,通过标准酸滴定,计算待测烧碱溶液的物质的量浓度是 , 烧碱样品的纯度是 . (本小题计算结果保留4位有效数字)
滴定次数 | 待测溶液 | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的 | ||
第①次 | 10.00 | 0.40 | 20.50 |
第②次 | 10.00 | 4.10 | 24.00 |
第③次 | 10.00 | 2.20 | 23.80 |
【答案】
(1)400;10﹣11
(2)b>a=c;c>a=b;a=b=c
(3)各取等体积醋酸和盐酸用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的是盐酸
(4)锥形瓶中溶液颜色变化;黄;橙;并且半分钟内不恢复原来的颜色;偏高;偏高;0.4000 mol?L﹣1;97.56%
【解析】解:(1)水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣26 , 则c(H+)=10﹣13mol/L,已知Kw=10﹣12 , c(OH)= ![]() =10mol/L,则氢氧化钠的物质的量为10mol/L×1L=10mol,则质量为10mol×40g/mol=400g;若保持温度不变,向水中通入的HCl气体恰好使溶液中
=10mol/L,则氢氧化钠的物质的量为10mol/L×1L=10mol,则质量为10mol×40g/mol=400g;若保持温度不变,向水中通入的HCl气体恰好使溶液中 ![]() =1010 , 已知Kw=10﹣12 , 则c(H+)=0.1mol/L,则水电离的c(OH﹣)=
=1010 , 已知Kw=10﹣12 , 则c(H+)=0.1mol/L,则水电离的c(OH﹣)= ![]() =10﹣11mol/L;所以答案是:400;10﹣11;(2)①物质的量浓度相同、体积相同时三种酸的物质的量相同,1mol硫酸消耗2molNaOH,所以醋酸和HCl均能消耗1molNaOH,所以使其恰好完全中和所需NaOH的物质的量由大到小的顺序是:b>a=c,
=10﹣11mol/L;所以答案是:400;10﹣11;(2)①物质的量浓度相同、体积相同时三种酸的物质的量相同,1mol硫酸消耗2molNaOH,所以醋酸和HCl均能消耗1molNaOH,所以使其恰好完全中和所需NaOH的物质的量由大到小的顺序是:b>a=c,
所以答案是:b>a=c;②当三种酸溶液氢离子浓度相同、体积也相同时,分别加入足量锌,由于醋酸为弱电解质,醋酸的物质的量浓度增大;盐酸和硫酸为强酸,含有的氢离子浓度相等,所以相同状况下产生气体的体积关系为:c>a=b;所以答案是:c>a=b;③当其c(H+)相同、体积相同时,与锌反应生成的氢气,开始时的速率相同,即:a=b=c;所以答案是:a=b=c;(3)弱酸稀释时促进电离,两种酸稀释相同的倍数后溶液中的氢离子浓度不等来比较,则各取等体积醋酸和盐酸用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的是盐酸;所以答案是:各取等体积醋酸和盐酸用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH值,pH值变化大的是盐酸;(4)①滴定过程中眼睛需要观察锥形瓶中溶液颜色变化,以判定滴定终点;用0.2000molL﹣1的标准盐酸进行滴定NaOH溶液,锥形瓶中为NaOH溶液和甲基橙,碱性时甲基橙为黄色,滴定终点时甲基橙变为橙色,到达滴定终点时:溶液从黄色变为橙色,并且半分钟内不恢复原来的颜色;所以答案是:锥形瓶中溶液颜色变化;黄;橙;并且半分钟内不恢复原来的颜色;②观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果,读数偏大,V(标准)偏大,由c(待测)= ![]() 可知,测定结果偏高;若将锥形瓶用待测液润洗,则待测溶液中溶质的物质的量偏大,消耗的标准溶液的体积偏大,由c(待测)=
可知,测定结果偏高;若将锥形瓶用待测液润洗,则待测溶液中溶质的物质的量偏大,消耗的标准溶液的体积偏大,由c(待测)= ![]() 可知,测定结果偏高;所以答案是:偏高;偏高;③所耗盐酸标准液的体积分别为:20.1mL,19.9mL、21.6mL,前两组数据均有效,盐酸标准液的平均体积为20.00mL;c(待测)=
可知,测定结果偏高;所以答案是:偏高;偏高;③所耗盐酸标准液的体积分别为:20.1mL,19.9mL、21.6mL,前两组数据均有效,盐酸标准液的平均体积为20.00mL;c(待测)= ![]() =
= ![]() =0.4000 molL﹣1 , 烧碱样品的纯度=
=0.4000 molL﹣1 , 烧碱样品的纯度= ![]() ×100%=97.56%,所以答案是:0.4000 molL﹣1;97.56%.
×100%=97.56%,所以答案是:0.4000 molL﹣1;97.56%.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理,以及对酸碱中和滴定的理解,了解中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

【题目】为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是( )
物质 | 除杂试剂 | 分离方法 | |
A | 硝酸铜溶液(硝酸银) | 铜粉 | 结晶 |
B | NaCl溶液(CuCl2) | NaOH溶液 | 萃取 |
C | 乙醇(水) | ------- | 分液 |
D | 铜粉(铁粉) | 稀盐酸 | 过滤 |
A.A
B.B
C.C
D.D
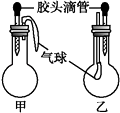
【题目】如图所示的甲、乙两个装置中(常温),胶头滴管中吸入某种液体,圆底烧瓶中充入(或放入)另一种物质,挤压胶头滴管中液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响).则所用试剂分别可能依次是( )
| 甲 | 乙 | |||
滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
A | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |
B | 水 | 钠 | 饱和碳酸钠溶液 | CO2 | |
C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 | |
D | 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO2 | |
A.A
B.B
C.C
D.D