题目内容
乙醇、液氨、水都可以发生自偶电离,如H2O+H2O?H3O++OH-,NH3+NH3?NH4++NH2-,则下列叙述正确的是( )
| A.乙醇的电离方程式:2CH3CH2OH?CH3CH2OH2++CH3CH2O- |
| B.液氨的离子积常数为:1.0×10-28,则液氨浓度为1.0×10-14mol/L |
| C.若可用与pH相当的定义来规定pOH、pNH2-等,则乙醇中与pH相当的为-lgc(CH3CH2OH2+) |
| D.乙醇中KW=c(CH3CH2OH2+).c(CH3CH2O-)=1.0×10-30,则此时的p CH3CH2O-=-15 |
A、根据自偶的实质是分子结合另一分子的氢离子形成阳离子,另一分子形成阴离子发生电离,乙醇的电离方程式:2CH3CH2OH?CH3CH2OH2++CH3CH2O-,故A正确;
B、液氨的离子积常数为:1.0×10-28,离子积常数结合水的离子积常数写出:[NH4+][NH2-]=1.0×10-28,根据电离方程式可知:NH3+NH3?NH4++NH2-,:[NH4+]=[NH2-]=1.0×10-14mol/L,所以液氨浓度大于1.0×10-14mol/L,故B错误;
C、水溶液中pH=-lg[H+],pOH=-lg[OH-],可类推pPH是用电离出的阳离子浓度的负对数计算,乙醇中与pH相当的为-lgc(CH3CH2OH2+),故C正确;
D、乙醇中KW=c(CH3CH2OH2+).c(CH3CH2O-)=1.0×10-30,电离方程式为2CH3CH2OH?CH3CH2OH2++CH3CH2O-,得到c(CH3CH2OH2+)=c(CH3CH2O-)=1.0×10-15,此时的p CH3CH2O-=-lg[1.0×10-15]=15,故D错误;
故选AC.
B、液氨的离子积常数为:1.0×10-28,离子积常数结合水的离子积常数写出:[NH4+][NH2-]=1.0×10-28,根据电离方程式可知:NH3+NH3?NH4++NH2-,:[NH4+]=[NH2-]=1.0×10-14mol/L,所以液氨浓度大于1.0×10-14mol/L,故B错误;
C、水溶液中pH=-lg[H+],pOH=-lg[OH-],可类推pPH是用电离出的阳离子浓度的负对数计算,乙醇中与pH相当的为-lgc(CH3CH2OH2+),故C正确;
D、乙醇中KW=c(CH3CH2OH2+).c(CH3CH2O-)=1.0×10-30,电离方程式为2CH3CH2OH?CH3CH2OH2++CH3CH2O-,得到c(CH3CH2OH2+)=c(CH3CH2O-)=1.0×10-15,此时的p CH3CH2O-=-lg[1.0×10-15]=15,故D错误;
故选AC.

练习册系列答案
相关题目
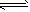 H3O++OH-,NH3+NH3
H3O++OH-,NH3+NH3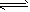 C2H5OH2++C2H5O-
C2H5OH2++C2H5O-