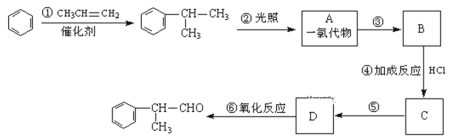
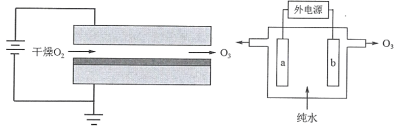
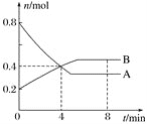
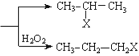题目内容
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表:
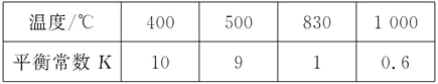
某温度下,平衡浓度符合下式:c(CO2)·c(H2)===c(CO)·c(H2O),试判断此时的温度为__℃。该反应正方向为__(填“放热反应”、“吸热反应”)
【答案】830 放热反应
【解析】
c(CO2)·c(H2)===c(CO)·c(H2O),即K=![]() ,随温度升高,平衡常数减小,说明升高温度平衡逆向移动。
,随温度升高,平衡常数减小,说明升高温度平衡逆向移动。
CO(g)+H2O(g)![]() CO2(g)+H2(g) K=
CO2(g)+H2(g) K=![]() ,若c(CO2)·c(H2)===c(CO)·c(H2O),则K=1,根据表中数据,反应温度是830℃。由表中数据可知,温度升高,K减小,说明升高温度,平衡逆向移动,正反应为放热反应。
,若c(CO2)·c(H2)===c(CO)·c(H2O),则K=1,根据表中数据,反应温度是830℃。由表中数据可知,温度升高,K减小,说明升高温度,平衡逆向移动,正反应为放热反应。

练习册系列答案
相关题目
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置中提供的物质完成相关实验,最合理的选项是( )
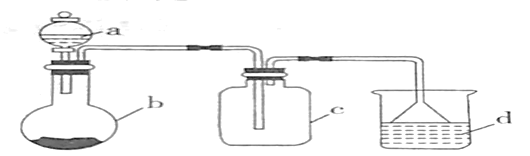
选项 | a中的溶液 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 生石灰 | NH3 | H2O |
B | 浓硝酸 | 铜片 | NO2 | H2O |
C | 稀硝酸 | 铜片 | NO | NaOH溶液 |
D | 浓硫酸 | 亚硫酸钠 | SO2 | NaOH溶液 |
A.AB.BC.CD.D