题目内容
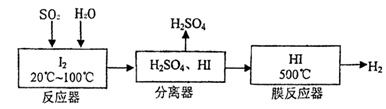
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。

(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。

(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入 ______ | __________ |
__________________________________________________。
(1)硫化氢水溶液(或硫化钠、硫氢化钠溶液) (2) 2Fe3++SO2+2H2O═2 Fe2+SO42-+4H+;
(3)(i)CaSO4;(ii)
(iii)Ca(ClO)2+H2O+SO2=CaSO4+2HCl。
(3)(i)CaSO4;(ii)
| 实验操作 | 预期现象和结论 |
| 加入过量(或适量)0.5 mol?L-1HCl,将产生的气体通入品红溶液(或新制澄清石灰水) | 若固体完全溶解,有气泡产生,且能使品红溶液褪色(或新制澄清石灰水变浑浊),则假设一成立;否则,假设一不成立; |
试题分析:(1)硫化氢水溶液(或硫化钠、硫氢化钠溶液)中的硫元素都为-2价,与二氧化硫反应,化合价会升高,被氧化,二氧化硫表现氧化性,如:2H2S+SO2=3S+2H2O中, SO2表现氧化性;(2)FeCl3溶液与SO2反应生成硫酸亚铁和盐酸,反应的离子方程式为2Fe3++SO2+2H2O═2 Fe2+SO42-+4H+;(3)(i)新制漂白粉浓溶液中含有的次氯酸根离子具有强氧化性,二氧化硫具有还原性,可能会发生氧化还原反应,生成产物可能为CaSO4;故假设二:该白色沉淀为CaSO4;(ii)基于假设一:白色沉淀为CaSO3,亚硫酸钙和盐酸反应CaSO3+2HCl═CaCl2+SO2↑+H2O,二氧化硫能使品红溶液褪色,也能使澄清石灰水变浑浊,实验操作为用另一干净试管取少量沉淀样品,加入过量(或适量)0.5 mol?L-1HCl,将产生的气体通入品红溶液(或新制澄清石灰水); 若固体完全溶解,有气泡产生,且能使品红溶液褪色(或新制澄清石灰水变浑浊),则假设一成立;否则,假设一不成立;(iii)若假设二成立,漂白粉浓溶液中含有的次氯酸根离子具有氧化性,能将二氧化硫氧化为硫酸根,生成该白色沉淀的化学方程式:Ca(ClO)2+H2O+SO2=CaSO4+2HCl。

练习册系列答案
相关题目
 ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。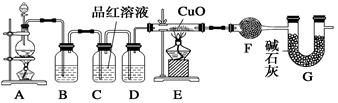
 和
和