题目内容
27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol?L-1 NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为( )
分析:向反应后混合溶液中滴加NaOH溶液,当溶液呈中性时,此时为硫酸钠溶液,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4),据此计算硫酸的物质的量,最终求出原硫酸的物质的量浓度.
解答:解:向反应后混合溶液中滴加NaOH溶液,当溶液呈中性时,此时为硫酸钠溶液,根据钠离子守恒有:
n(NaOH)=2n(Na2SO4),
根据硫酸根守恒有n(H2SO4)=n(Na2SO4)=
n(NaOH)=
×0.5L×2mol/L=0.5mol,
所以原硫酸的物质的量浓度为
=1mol/L.
故选D.
n(NaOH)=2n(Na2SO4),
根据硫酸根守恒有n(H2SO4)=n(Na2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
所以原硫酸的物质的量浓度为
| 0.5mol |
| 0.5L |
故选D.
点评:本题涉及的化学反应比较多,计算过程也很复杂,用守恒法计算,不但思路清楚,而且解题简单.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
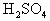 中发现固体完全溶解并放出4.48L
中发现固体完全溶解并放出4.48L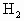 (标准状况),加入
(标准状况),加入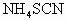 后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为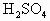 中发现固体完全溶解并放出4.48L
中发现固体完全溶解并放出4.48L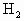 (标准状况),加入
(标准状况),加入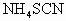 后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
后溶液颜色无变化.然后向溶液中加入2mol/LNaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为