题目内容
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NO2经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。
T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:

(1)T℃时,反应3NO(g)+O3(g) ![]() 3NO2(g)的△H=_______________kJ.mol-1。
3NO2(g)的△H=_______________kJ.mol-1。
(2)T℃时,将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
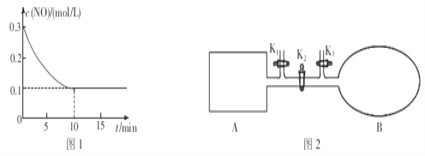
①T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的平衡常数K=______________。
3NO2(g)的平衡常数K=______________。
②不能说明反应达到平衡状态的是______________。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1:3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
①若容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=________________。
②若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为__________L。
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数______________(填“变大”“变小”或“不变”)。
【答案】 -317.1 240(或240 L.mol一1) C ![]() 0.7a 变小
0.7a 变小
【解析】Ⅰ.(1)①NO(g)+O3(g)NO2(g)+O2(g)△H=-200.9 kJ/mol,②2NO(g)+O2(g)2NO2(g)△H=-116.2 kJ/mol,①+②得到T℃时,反应3NO(g)+O3(g)3NO2(g)的△H=-317.1kJ/mol,故答案为:-317.1;
(2)①T℃时,将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,图象分析可知平衡状态NO浓度为0.1mol/L,10min达到平衡,
3NO(g)+O3(g)3NO2(g)
起始量(mol/L) 0.3 0.1 0
变化量(mol/L) 0.2 ![]() 0.2
0.2
平衡量(mol/L) 0.1 ![]() 0.2
0.2
K=![]() =240,故答案为:240;
=240,故答案为:240;
②反应3NO(g)+O3(g)3NO2(g)的△H=-317.1kJ/mol,反应是气体体积减小的放热反应。A.气体颜色不再改变,说明二氧化氮浓度不变,反应达到平衡状态,故A不符合;B.反应前后气体质量不变,物质的量变化,当气体的平均摩尔质量不再改变说明反应达到平衡状态,故B不符合;C.气体质量和体积不变,气体的密度始终不改变,不能说明反应达到平衡状态,故C符合;D.反应速率之比等于化学方程式计量数之比为正反应速率之比,当单位时间内生成O3和NO2物质的量之比为1:3,表明正逆反应速率相同,反应达到平衡状态,故D不符合;故答案为:C;
Ⅱ.(3)①关闭K2,将各1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL,若容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,设生成四氧化二氮为x
2NO2(g)N2O4(g)
起始量 1 0
变化量 2x x
平衡量 1-2x x
1-2x+x=0.8×1,解得:x=0.2mol,则平均化学反应速率v(NO2)=![]() =
=![]() mol/(Ls),故答案为:
mol/(Ls),故答案为:![]() mol/(Ls);
mol/(Ls);
②打开K2,则相当于是在等温等压时的平衡,因此平衡是等效的,由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,故答案为:0.7a;
③若平衡后在A容器中再充入0.5molN2O4,相当于中等压强,平衡正向进行,则重新到达平衡后,平衡混合气中NO2的体积分数变小,故答案为:变小。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案