题目内容
【题目】常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL0.1000 mol/L CH3COOH溶液所得滴定曲线如图。下列说法正确的是
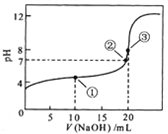
A. 点①所示溶液中:c(CH3COO-)+ c(OH-)=c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+) >c(OH-) >c(CH3COO-) > c(H+)
D. 滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) > c(H+)>c(Na+) >c(OH-)
【答案】D
【解析】试题分析:A、点①溶液中,加入10mL氢氧化钠溶液,此时溶质为等浓度的醋酸和醋酸钠溶液,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则c(H+)>c(OH-),电荷守恒电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),c(CH3COOH)<c(Na+)<c(CH3COO-),所以溶液中c(CH3COOH)+c(H+)<c(CH3COO-)+c(OH-),故A错误;B、点②pH=7,即c(H + )=c(OH-),由电荷守恒知:c(Na + ) + c(H + )=c(CH3COO-) + c(OH-),故c(Na + )=c(CH3COO-),故B错误;C、点③说明两溶液恰好完全反应生成CH3COONa,醋酸根离子的水解程度较小,则溶液中氢氧根离子浓度较小,故c(OH-)<<c(CH3COO-),正确的浓度大小为:c(Na + )>c(CH3COO-)>c(OH-)>c(H + ),故C错误;D、如果出现c(CH3COOH)>c(CH3COO-)>c(H + )>c(Na + )>c(OH-)满足电荷守恒关系,故D正确;故选D。

 阅读快车系列答案
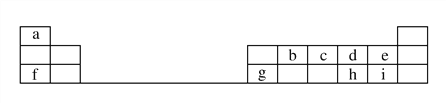
阅读快车系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出③和⑥两种元素的元素符号:③________⑥_________;
(2)②和④两种元素形成的共价化合物的电子式是________________;
(3)元素②的气态氢化物的分子式为____________,
元素⑨最高价氧化物对应水化物的分子式为____________;
(4)④、⑤、⑧的原子半径由大到小的顺序为____________________;
(5) ②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________;
(6) ②、③、⑦的气态氢化物中最不稳定的是___________(填化学式);
(7)用电子式表示H2O的形成过程___________________。