题目内容
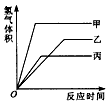
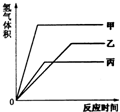 等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积(同温同压)与反应时间的关系如图所示,则下列说法正确的是( )
等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积(同温同压)与反应时间的关系如图所示,则下列说法正确的是( )分析:由产生氢气的体积与反应时间的关系图,等质量的甲最先完成反应而乙最后反应完成;完全反应后甲放出氢气量最大而丙最小.
解答:解:A、等质量的甲、乙、丙三种金属,甲最先完成反应,其次为丙,而乙最后反应完全,因此可判断三种金属的活动性大小为甲>丙>乙;故A不正确;
B、反应所放出氢气质量全部来自于稀硫酸,由于所放出氢气的质量不同,因此所消耗硫酸的质量一定不相同;故B不正确;
C、根据一定量金属完全反应产生氢气质量=
×金属的质量,因此金属的质量及化合价均相同,所以金属的相对原子质量与反应放出氢气的多少成反应比,则三种金属的相对原子质量是丙>乙>甲;故C不正确;
D、等质量的三种金属,甲最先完成反应,其次为丙,而乙最后反应完全,因此反应速率最快的是甲,最慢的是乙;故D正确;
故选D.
B、反应所放出氢气质量全部来自于稀硫酸,由于所放出氢气的质量不同,因此所消耗硫酸的质量一定不相同;故B不正确;
C、根据一定量金属完全反应产生氢气质量=
| 金属化合价 |
| 金属的相对原子质量 |
D、等质量的三种金属,甲最先完成反应,其次为丙,而乙最后反应完全,因此反应速率最快的是甲,最慢的是乙;故D正确;
故选D.
点评:金属活动性越强,金属与酸反应越剧烈,在相同时间放则放出氢气的量越多,即反应速率越快.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
甲、乙、丙是三种不含相同离子的可溶性强电解质.它们所含的离子如表所示,若取等质量的甲、乙、丙配制成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),则乙物质( )
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3-、SO42- |
| A、可能是NaOH |
| B、可能是NH4NO3 |
| C、不可能有SO42- |
| D、一定不是(NH4)2SO4 |

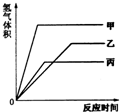 等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积(同温同压)与反应时间的关系如图所示,则下列说法正确的是
等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积(同温同压)与反应时间的关系如图所示,则下列说法正确的是