题目内容
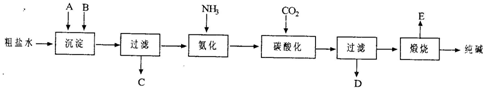
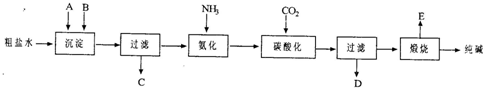
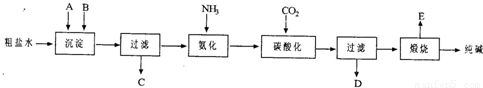
工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.

请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______.
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):______.
解:(1)实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步,若液面高于滤纸边缘或滤纸破了,会使滤液仍然浑浊,
故答案为:溶解;蒸发;液面高于滤纸边缘或滤纸破了;
(2)配制500mL 1.00mol.L-1NaCl溶液,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用筒量取水),用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、500ml的容量瓶、胶头滴管,使用的仪器除药匙、玻璃棒、量筒外,还需要托盘天平、烧杯、500ml的容量瓶、胶头滴管,
故答案为:托盘天平、烧杯、500ml的容量瓶、胶头滴管;
(3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠,根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有NaHCO3等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分为:NH4Cl;检验其中的氯离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子,
故答案为:碳酸钠溶解度比碳酸氢钠大;NH4Cl;取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
(4)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH- NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O,故答案为:NH4++OH- NH3↑+H2O;
NH3↑+H2O;
(5)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为: ;故纯碱中含有的碳酸氢钠的质量分数为
;故纯碱中含有的碳酸氢钠的质量分数为 ,故答案为:
,故答案为: .
.
分析:(1)根据实验室提纯粗盐的整个操作过程来回答;根据过滤操作要注意一贴、二低、三靠;
(2)根据配制溶液的步骤操作选择所用仪器;
(3)根据碳酸氢钠的溶解度小于碳酸钠;根据题意知道通入二氧化碳后主要发生复分解反应结合质量守恒定律得知溶液中主要是NH4Cl来回答;根据氯离子的检验方法;
(4)根据铵盐能与碱反应生成氨气;
(5)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质来回答.
点评:本题以工业生产纯碱的工艺流程为背景,考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,难度中等.
故答案为:溶解;蒸发;液面高于滤纸边缘或滤纸破了;
(2)配制500mL 1.00mol.L-1NaCl溶液,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用筒量取水),用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、500ml的容量瓶、胶头滴管,使用的仪器除药匙、玻璃棒、量筒外,还需要托盘天平、烧杯、500ml的容量瓶、胶头滴管,
故答案为:托盘天平、烧杯、500ml的容量瓶、胶头滴管;
(3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠,根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有NaHCO3等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分为:NH4Cl;检验其中的氯离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子,
故答案为:碳酸钠溶解度比碳酸氢钠大;NH4Cl;取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
(4)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH-
 NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O,故答案为:NH4++OH- NH3↑+H2O;
NH3↑+H2O;(5)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为:
 ;故纯碱中含有的碳酸氢钠的质量分数为
;故纯碱中含有的碳酸氢钠的质量分数为 ,故答案为:
,故答案为: .
.分析:(1)根据实验室提纯粗盐的整个操作过程来回答;根据过滤操作要注意一贴、二低、三靠;
(2)根据配制溶液的步骤操作选择所用仪器;
(3)根据碳酸氢钠的溶解度小于碳酸钠;根据题意知道通入二氧化碳后主要发生复分解反应结合质量守恒定律得知溶液中主要是NH4Cl来回答;根据氯离子的检验方法;
(4)根据铵盐能与碱反应生成氨气;
(5)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质来回答.
点评:本题以工业生产纯碱的工艺流程为背景,考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,难度中等.

练习册系列答案
相关题目