题目内容
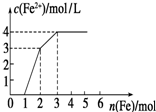
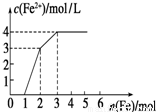
 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.(忽略溶液体积变化)
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.(忽略溶液体积变化)(1)加入1mol铁粉时,所得溶液的主要成分是
(2)实验中可产生标准状态下的气体体积为
(3)原溶液Fe(NO3)3的浓度为
分析:根据氧化性:HNO3>Fe3+>Cu2+,Fe先与氧化性强的物质反应,即Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,然后是:Fe+2Fe3+=3Fe2+,最后阶段Fe+Cu2+═Fe2++Cu,由图中起点、拐点、终点的位置来确定化学反应情况.
解答:解:(1)Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液氧化性为HNO3>Fe3+>Cu2+,金属铁先和氧化性强的离子反应,当加入金属铁1mol是发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,所得溶液的主要成分是Fe(NO3)3、Cu(NO3)2,故答案为:Fe(NO3)3、Cu(NO3)2;
(2)只有在第一阶段产生气体,由方程式可知:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
1mol 22.4L
故答案为:22.4;
(3)第二阶段与三价铁反应,而第一阶段生成1mol的Fe(NO3)3,而第二阶段消耗1mol的铁,由方程式知:
Fe+2Fe3+=3Fe2+
1mol 2mol
1mol 2mol
所以原溶液中硝酸铁的物质的量为:2mol-1mol=1mol,
第三阶段加铁粉1mol,亚铁离子的浓度增加1mol/L,即溶液的体积为1L,所以c(Fe(NO3)3)=1mol/L,故答案为:1mol/L.
(2)只有在第一阶段产生气体,由方程式可知:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
1mol 22.4L
故答案为:22.4;
(3)第二阶段与三价铁反应,而第一阶段生成1mol的Fe(NO3)3,而第二阶段消耗1mol的铁,由方程式知:
Fe+2Fe3+=3Fe2+
1mol 2mol
1mol 2mol
所以原溶液中硝酸铁的物质的量为:2mol-1mol=1mol,
第三阶段加铁粉1mol,亚铁离子的浓度增加1mol/L,即溶液的体积为1L,所以c(Fe(NO3)3)=1mol/L,故答案为:1mol/L.
点评:本题考查学生金属铁所发生的氧化还原反应知识,注意平时知识的积累是解题的关键,综合性较强,结合图象考查增加了难度.

练习册系列答案
相关题目
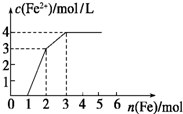
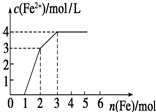 (2013?邯郸模拟)向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.下列离子方程式错误的是( )
(2013?邯郸模拟)向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.下列离子方程式错误的是( )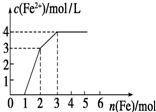 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.下列离子方程式错误的是
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.下列离子方程式错误的是