题目内容
以海水为原料获取金属镁,其中重要的一步是获得无水MgCl2,然后通过电解法制得金属镁.请回答下列问题:
(1)使氯化镁晶体失去结晶水的方法是______,选择电解MgCl2制金属镁而不选用MgO的主要理由是______.
(2)某兴趣小组同学取用80.00g的MgCl2溶液(含镁元素质量分数为15.00%),将其小心蒸干得49.25g固体(其成分表示为Mgx(OH)yClz?nH2O),为研究其组成进行了如下两实验:
实验一:将所得固体全部溶于100mL 1.50mol/L的盐酸中,再加水稀释至500mL,测溶液的pH为1;
实验二:取实验一稀释后的溶液50mL向其中加入足量的AgNO3溶液得沉淀12.915g.
①你认为上述两实验是否有必要都做?______理由是______;
②所得固体中Cl-的物质的量为______mol;
③试通过计算确定固体的化学式.
解:(1)使氯化镁晶体失去结晶水的方法是在HCl氛围中加热,否则氯化镁会水解,选择电解MgCl2制金属镁而不选用MgO的主要理由是MgO熔点比MgCl2高,熔化时能耗高,
故答案为:在HCl氛围中加热;MgO熔点比MgCl2高,熔化时能耗高;
(2)①实验一可确定OH-的量,根据电荷守恒可确定Cl-的量,实验二没有必要做,如做实验二,则实验一没有必要做,因为Mg2+的量已知,只要OH-、Cl-确定一个,另一个利用电荷守恒就可确定,
故答案为:没有必要;因为Mg2+的量已知,只要OH-、Cl-确定一个,另一个利用电荷守恒就可确定;
②n (Cl-)= ×
× =0.9mol,
=0.9mol,
故答案为:0.9mol;
③n(Mg2+)=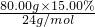 =0.5mol,n(HCl)=0.1L×1.50mol/L=0.15mol,500mL溶液中
=0.5mol,n(HCl)=0.1L×1.50mol/L=0.15mol,500mL溶液中
n(H+)=0.1mol/L×0.5L=0.05mol,n (OH-)=n(HCl)-n(H+)=0.15mol-0.05mol=0.1mol,
由电荷守恒可知2n(Mg2+)=n (OH-)+n (Cl-),则n (Cl-)=2×0.5mol-0.1mol=0.9mol,
n (H2O)= =0.2mol
=0.2mol
故n(Mg2+):n (OH-):n (Cl-):n (H2O)=0.5:0.1:0.9:0.2=5:1:9:2
即化学式为:Mg5(OH)Cl9?2H2O.
答:固体的化学式为Mg5(OH)Cl9?2H2O.
分析:(1)氯化镁易水解,为离子化合物,熔融状态下可导电,且熔点比氧化镁低,以此解答该题.
(2)根据镁离子的量结合电荷守恒可确定氯离子或氢氧根离子的量,以此可确定化学式.
点评:本题以海水资源的综合利用为背景综合考查物质的含量测定,侧重于考查学生的分析能力、实验能力和计算能力,题目难度中等,注意结合质量守恒和电荷守恒解答该题.
故答案为:在HCl氛围中加热;MgO熔点比MgCl2高,熔化时能耗高;
(2)①实验一可确定OH-的量,根据电荷守恒可确定Cl-的量,实验二没有必要做,如做实验二,则实验一没有必要做,因为Mg2+的量已知,只要OH-、Cl-确定一个,另一个利用电荷守恒就可确定,
故答案为:没有必要;因为Mg2+的量已知,只要OH-、Cl-确定一个,另一个利用电荷守恒就可确定;
②n (Cl-)=
 ×
× =0.9mol,
=0.9mol,故答案为:0.9mol;
③n(Mg2+)=
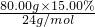 =0.5mol,n(HCl)=0.1L×1.50mol/L=0.15mol,500mL溶液中
=0.5mol,n(HCl)=0.1L×1.50mol/L=0.15mol,500mL溶液中n(H+)=0.1mol/L×0.5L=0.05mol,n (OH-)=n(HCl)-n(H+)=0.15mol-0.05mol=0.1mol,
由电荷守恒可知2n(Mg2+)=n (OH-)+n (Cl-),则n (Cl-)=2×0.5mol-0.1mol=0.9mol,
n (H2O)=
 =0.2mol
=0.2mol故n(Mg2+):n (OH-):n (Cl-):n (H2O)=0.5:0.1:0.9:0.2=5:1:9:2
即化学式为:Mg5(OH)Cl9?2H2O.
答:固体的化学式为Mg5(OH)Cl9?2H2O.
分析:(1)氯化镁易水解,为离子化合物,熔融状态下可导电,且熔点比氧化镁低,以此解答该题.
(2)根据镁离子的量结合电荷守恒可确定氯离子或氢氧根离子的量,以此可确定化学式.
点评:本题以海水资源的综合利用为背景综合考查物质的含量测定,侧重于考查学生的分析能力、实验能力和计算能力,题目难度中等,注意结合质量守恒和电荷守恒解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目