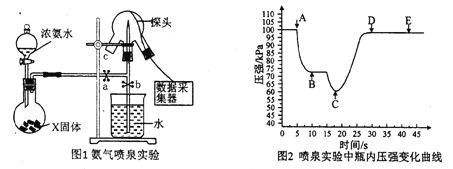
题目内容
【题目】工业上回收利用某合金废料(主要含Fe、Al、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
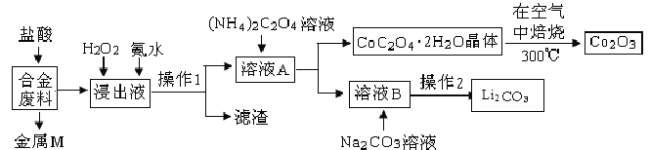
(1) 金属M为 ,操作1所用的玻璃仪器除烧杯外还有 。
(2) 加入H2O2的作用是 (用离子方程式表示),加入氨水的作用是 。
(3) 在空气中焙烧的化学方程式为 。
(4) 已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5) 用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
【答案】(1)Cu;漏斗、玻璃棒
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀
(3)4CoC2O42H2O+3O2![]() 2Co2O3+8 H2O+8CO2
2Co2O3+8 H2O+8CO2
(4)减少Li2CO3的溶解损失;(5)2CO32--4e-=O2↑+2CO2↑
【解析】
试题分析:合金废料(主要含Fe、Al、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)加入盐酸过滤得到金属M为不与盐酸反应的铜,浸出液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液pH使铁离子转化为氢氧化铁沉淀、氢氧化铝,通过操作Ⅰ过滤得到溶液A中加入草酸铵溶液沉淀钴离子过滤得到溶液B主要是锂离子的溶液,加入碳酸钠沉淀锂离子,过滤得到碳酸锂;结晶析出CoC2O42H2O足量空气煅烧得到氧化钴。
(1)上述分析判断金属M为Cu,操作Ⅰ为过滤操作,所用的玻璃仪器除烧杯外还有漏斗和玻璃棒;
(2)加入H2O2的作用是氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀;
(3)CoC2O4焙烧生成Co2O3、CO2和水,反应的化学方程式为4CoC2O42H2O+3O2![]() 2Co2O3+8 H2O+8CO2;
2Co2O3+8 H2O+8CO2;
(4)Li2CO3微溶于水,溶解度随温度升高而降低,为减少Li2CO3的溶解损失,蒸发浓缩后必须趁热过滤;
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,应为二氧化碳和氧气,电极方程式为2CO32--4e-=O2↑+2CO2↑。

 阅读快车系列答案
阅读快车系列答案