题目内容
【题目】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2molL-1的氢氟酸中滴加0.2molL-1的NaOH溶液时,溶液的pH变化如图所示。
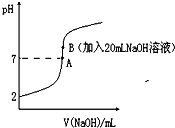
已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____,电离度α(HF)为______%。
(3)下列有关图中各点微粒浓度关系正确的是________。
a.在A处溶液中:c(F—)+c(HF)=0.2 molL-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序 ___________________________________________
【答案】 ad a 5.3×10-4 或5×10-4 5 b d C(F-)>C(Na+)> C(HF) >C(H+)>C(OH_)
【解析】(1)HF酸中存在HF H+ + F-,电离度![]() ,平衡常数Ka只与温度有关。a、HF的电离吸热,升高温度,平衡右移,电离度增大,Ka增大;b、向溶液中滴入2滴浓盐酸, H+浓度增大,平衡左移,电离度减小,Ka不变;c、加入少量NaF固体,F-浓度增大,平衡左移,电离度减小,Ka不变;d、加水稀释,促进电离,电离度增大,Ka不变。
,平衡常数Ka只与温度有关。a、HF的电离吸热,升高温度,平衡右移,电离度增大,Ka增大;b、向溶液中滴入2滴浓盐酸, H+浓度增大,平衡左移,电离度减小,Ka不变;c、加入少量NaF固体,F-浓度增大,平衡左移,电离度减小,Ka不变;d、加水稀释,促进电离,电离度增大,Ka不变。
故答案为:ad;a;
(2)由图象可知0.2molL-1的氢氟酸pH=2, c(H+)=0.01mol/L,则已电离c(HF)=0.01mol/L,α=![]() ,Ka=
,Ka=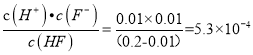
故答案为:5.3×10-4 或5×10-4; 5;
(3)a、该选项考查物料守恒,20mL0.2molL-1的氢氟酸中,物料守恒为:c(F-)+c(HF)=0.2molL-1,在A处溶液中,由于加入NaOH溶液,则溶液总体积大于20mL,则c(F-)+c(HF)<0.2molL-1,故a错误;b、在B处溶液中,HF和NaOH完全反应生成NaF,由质子守恒可知:c(H+)+c(HF)=c(OH-),故b正确;c、在B处溶液pH>7,则c(H+)<c(OH-),故c错误;d、由于温度不变,则电离常数不变,则在A和B处溶液中都符合: 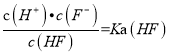 ,故d正确。
,故d正确。
故答案为:bd;
(4)向此氢氟酸溶液中滴加10mL NaOH溶液,反应后溶液为等物质的量HF和NaF的混合物,HF过量,溶液呈酸性,离子浓度大小关系应为c(F-)>c(Na+)>c(HF)>c(H+)>c(OH-),
故答案为:c(F-)>c(Na+)>c(HF)>c(H+)>c(OH-)。
