题目内容
15.现有8000kg含CaF280%(质量分数)的萤石和足量浓硫酸作用后,能制得40%(质量分数)HF溶液多少千克?同时要消耗96%(质量分数)H2SO4多少千克?(设:氢氟酸的产率是85%)分析 萤石和浓硫酸反应方程式为CaF2+H2SO4=CaSO4+2HF,根据氟化钙和HF之间的关系式计算生成HF溶液质量;根据氟化钙和浓硫酸的关系式计算消耗浓硫酸质量.
解答 解:设生成40%HF溶液的质量是x,消耗96%的浓硫酸y,
CaF2+H2SO4=CaSO4+2HF
78g 98g 40g
8000kg×80%×85% 96%y 40%x
78g:98g=8000kg×80%×85%:96%y,
y=$\frac{8000kg×80%×85%×98g}{78g×96%}$=7120kg,
78g:40g=8000kg×80%×85%:40%x
x=$\frac{8000kg×80%×85%×40g}{78g×40%}$=6564kg,
答:能制得40%(质量分数)HF溶液6564千克;同时要消耗96%(质量分数)H2SO47120千克.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量关系是解本题关键,计算量较大,但题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
12.某醇A通过一系列反应可得到丙三醇,还可以通过氧化反应、酯化反应、加聚反应最后得到高分子化合物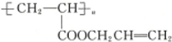 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )
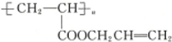 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )| A. | CH3CH2CH2OH | B. | CH2═CHCH2OH | C. |  | D. | 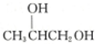 |
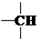 和一个-Cl,它的可能结构分别是(填写结构简式):CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构分别是(填写结构简式):CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.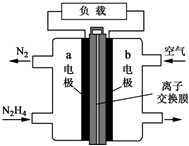 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题: