题目内容
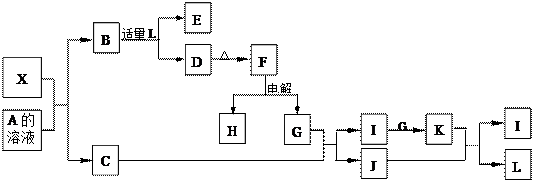
X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近. X有如下的转化关系:其中,C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色胶状沉淀,E溶液的焰色反应火焰呈黄色,M是一种常见金属,过量的M与L可生成Q和I.

(1)X与A溶液反应的离子方程式为
(2)把红热的木炭投入到L的浓溶液中,可发生剧烈反应,①化学方程式为
②若把产生的气体通入足量的饱和碳酸氢钠溶液中,再把逸出的气体干燥后通入足量的过氧化钠固体,充分反应后,再通入水中,最后收集到的气体是
③若把产生的气体直接通入足量的澄清石灰水中,现象是
(3)将K、I、G混合气体充满容器后倒置于水槽中,气体完全溶解,溶液充满整个容器.则三者的物质的量之比可能为
A.1:1:1 B.4:2:2.5 C.4:8:7 D.6:4:5
所得溶液的浓度范围
(4)熔融条件下,化合物A中金属元素所对应的单质Z与Q可组成可充电电池(装置如下),

反应原理为:2Z+Q
M+2E
①放电时,电池的正极反应式为
②充电时,

(1)X与A溶液反应的离子方程式为
AlN+H2O+OH-=AlO2-+NH3↑
AlN+H2O+OH-=AlO2-+NH3↑
.(2)把红热的木炭投入到L的浓溶液中,可发生剧烈反应,①化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
②若把产生的气体通入足量的饱和碳酸氢钠溶液中,再把逸出的气体干燥后通入足量的过氧化钠固体,充分反应后,再通入水中,最后收集到的气体是
O2
O2
.③若把产生的气体直接通入足量的澄清石灰水中,现象是
开始无沉淀,最后有白色沉淀生成,溶液上方出现红棕色
开始无沉淀,最后有白色沉淀生成,溶液上方出现红棕色
.(3)将K、I、G混合气体充满容器后倒置于水槽中,气体完全溶解,溶液充满整个容器.则三者的物质的量之比可能为
ABC
ABC
A.1:1:1 B.4:2:2.5 C.4:8:7 D.6:4:5
所得溶液的浓度范围
0.026~0.36
0.026~0.36
(标准状况)(4)熔融条件下,化合物A中金属元素所对应的单质Z与Q可组成可充电电池(装置如下),

反应原理为:2Z+Q
| 放电 |
| 充电 |
①放电时,电池的正极反应式为
Fe2++2e-=Fe
Fe2++2e-=Fe
;②充电时,
钠
钠
(写物质名称)电极接电源的负极.分析:C是一种能使湿润的红色石蕊试纸变蓝的无色气体为NH3,D为白色胶状沉淀结合生成的F电解判断D为Al(OH)3,F为Al2O3,G为O2,H为Al,把红热的木炭投入到L的浓溶液中,可发生剧烈反应,可以判断I为NO,J为H2O,K为NO2,L为HNO3,M是一种常见金属,过量的M与L可生成Q和I,证明M为Fe,Q为Fe(NO3)2,转化关系中,E溶液的焰色反应火焰呈黄色说明含钠元素,B和适量的硝酸反应生成氢氧化铝沉淀和E,证明B为偏铝酸钠NaAlO2,E为NaNO3,X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近.结合和A反应产物判断X为AlN,A为氢氧化钠溶液;依据判断出的物质分析判断回答问题.
解答:解:C是一种能使湿润的红色石蕊试纸变蓝的无色气体为NH3,D为白色胶状沉淀结合生成的F电解判断D为Al(OH)3,F为Al2O3,G为O2,H为Al,把红热的木炭投入到L的浓溶液中,可发生剧烈反应,可以判断I为NO,J为H2O,K为NO2,L为HNO3,M是一种常见金属,过量的M与L可生成Q和I,证明M为Fe,Q为Fe(NO3)2,转化关系中,E溶液的焰色反应火焰呈黄色说明含钠元素,B和适量的硝酸反应生成氢氧化铝沉淀和E,证明B为偏铝酸钠NaAlO2,E为NaNO3,X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近.结合和A反应产物判断X为AlN,A为氢氧化钠溶液;
(1)X与A溶液反应的离子方程式为:AlN+H2O+OH-=AlO2-+NH3↑,故答案为:AlN+H2O+OH-=AlO2-+NH3↑;
(2)把红热的木炭投入到L(HNO3)的浓溶液中,可发生剧烈反应,①化学方程式为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
②把产生的气体通入足量的饱和碳酸氢钠溶液中,按照二氧化碳和二氧化氮物质的量为1:4,发生反应3NO2+H2O=2HNO3+NO;得到二氧化碳1+
=
和一氧化氮
,再把逸出的气体干燥后通入足量的过氧化钠固体,充分反应后,生成氧气
,再通入水中,依据反应计算:4NO+O2+2H2O=4HNO3,一氧化氮全部反应,剩余氧气=
-
=
=1.5,最后收集到的气体为O2,
故答案为:O2;
③把产生的气体直接通入足量的澄清石灰水中,二氧化氮与水反应生成硝酸和一氧化氮,硝酸和氢氧化钙反应,所以开始无沉淀,最后有白色沉淀碳酸钙生成,一氧化氮遇到空气中的氧气反应生成二氧化氮气体,溶液上方出现红棕色,
故答案为:开始无沉淀,最后有白色沉淀生成,溶液上方出现红棕色;
(3)将K(NO2)、I(NO)、G(O2)混合气体充满容器后倒置于水槽中,气体完全溶解,溶液充满整个容器.则三者的物质的量之比可能为:
A.1:1:1时,NO2+NO+O2+H2O=2HNO3;气体可以全部溶解,故A符合;
B.4:2:2.5 时,按照4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;分析气体恰好溶于水,故B符合;
C.4:8:7,按照4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;分析气体恰好溶于水,故C符合;
D.6:4:5,按照4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;分析计算反应后剩余氧气0.5,气体不能全部溶于水,故D不符合;
故选ABC;
所得溶液的浓度范围可以用极值法计算发生反应:4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;的溶液浓度计算判断,
按照反应:4NO2+O2+2H2O=4HNO3;进行,气体体积为5L,二氧化氮为4L,则溶液浓度=
=0.36mol/L
按照反应:4NO+3O2+2H2O=4HNO3,进行,气体体积为7L,一氧化氮为4L,则溶液浓度=
=0.026mol/L;
所以所得溶液的浓度范围为0.026~0.36,
故答案为:ABC;0.026~0.36;
(4)熔融条件下,化合物A中金属元素所对应的单质Z(Na)与Q(Fe(NO3)2)可组成可充电电池,
反应原理为:2Z(Na)+Q(Fe(NO3)2)
M(Fe)+2E(NaNO3),
①依据电池反应,放电时正极为亚铁离子被还原为Fe,电池的正极反应式为:Fe2++2e-=Fe,故答案为:Fe2++2e-=Fe;
②依据充电电池装置可知,放电时熔融钠电极做负极,熔融Fe(NO3)2电极做正极;充电时原电池的负极解电源负极做电解池阴极,原电池的正极接电源正极做电解池的阳极,所以充电时钠接电源的负极,故答案为:钠.
(1)X与A溶液反应的离子方程式为:AlN+H2O+OH-=AlO2-+NH3↑,故答案为:AlN+H2O+OH-=AlO2-+NH3↑;
(2)把红热的木炭投入到L(HNO3)的浓溶液中,可发生剧烈反应,①化学方程式为:C+4HNO3(浓)
| ||
| ||
②把产生的气体通入足量的饱和碳酸氢钠溶液中,按照二氧化碳和二氧化氮物质的量为1:4,发生反应3NO2+H2O=2HNO3+NO;得到二氧化碳1+
| 8 |
| 3 |
| 11 |
| 3 |
| 4 |
| 3 |
| 11 |
| 6 |
| 11 |
| 6 |
| 1 |
| 3 |
| 9 |
| 6 |
故答案为:O2;
③把产生的气体直接通入足量的澄清石灰水中,二氧化氮与水反应生成硝酸和一氧化氮,硝酸和氢氧化钙反应,所以开始无沉淀,最后有白色沉淀碳酸钙生成,一氧化氮遇到空气中的氧气反应生成二氧化氮气体,溶液上方出现红棕色,
故答案为:开始无沉淀,最后有白色沉淀生成,溶液上方出现红棕色;
(3)将K(NO2)、I(NO)、G(O2)混合气体充满容器后倒置于水槽中,气体完全溶解,溶液充满整个容器.则三者的物质的量之比可能为:
A.1:1:1时,NO2+NO+O2+H2O=2HNO3;气体可以全部溶解,故A符合;
B.4:2:2.5 时,按照4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;分析气体恰好溶于水,故B符合;
C.4:8:7,按照4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;分析气体恰好溶于水,故C符合;
D.6:4:5,按照4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;分析计算反应后剩余氧气0.5,气体不能全部溶于水,故D不符合;
故选ABC;
所得溶液的浓度范围可以用极值法计算发生反应:4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3;的溶液浓度计算判断,
按照反应:4NO2+O2+2H2O=4HNO3;进行,气体体积为5L,二氧化氮为4L,则溶液浓度=
| ||
| 5 |
按照反应:4NO+3O2+2H2O=4HNO3,进行,气体体积为7L,一氧化氮为4L,则溶液浓度=
| ||
| 7 |
所以所得溶液的浓度范围为0.026~0.36,
故答案为:ABC;0.026~0.36;
(4)熔融条件下,化合物A中金属元素所对应的单质Z(Na)与Q(Fe(NO3)2)可组成可充电电池,
反应原理为:2Z(Na)+Q(Fe(NO3)2)
| 放电 |
| 充电 |
①依据电池反应,放电时正极为亚铁离子被还原为Fe,电池的正极反应式为:Fe2++2e-=Fe,故答案为:Fe2++2e-=Fe;
②依据充电电池装置可知,放电时熔融钠电极做负极,熔融Fe(NO3)2电极做正极;充电时原电池的负极解电源负极做电解池阴极,原电池的正极接电源正极做电解池的阳极,所以充电时钠接电源的负极,故答案为:钠.
点评:本题考查了物质转化关系的推断应用,物质性质的综合应用,主要考查氮化铝新型材料的性质应用,氨气、碳、铝及其化合物、铁,硝酸,氮的氧化物性质的应用,氮氧化物的混合计算应用,原电池,电解池的原理分析,题目综合性大,难度较大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
 (12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
(12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________ __________;
写出K与J反应的化学方程式:____________________________ _____。
|
 4X+SiC+3C。
4X+SiC+3C。 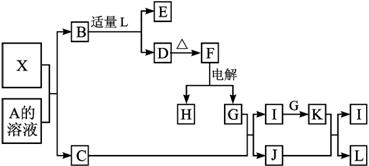

 。
。