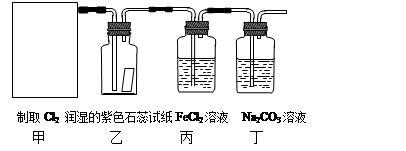
题目内容
实验室中常用二氧化锰与浓盐酸共热来制取氯气.如果没有二氧化锰,可以用高锰酸钾在常温下与浓盐酸反应来制取.
(1)写出实验室用二氧化锰与浓盐酸共热来制取氯气的化学方程式.
(2)常温下,高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+.写出该反应化学方程式.
(1)写出实验室用二氧化锰与浓盐酸共热来制取氯气的化学方程式.
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
(2)常温下,高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+.写出该反应化学方程式.
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
.分析:(1)二氧化锰与浓盐酸反应生成氯化锰、水、氯气;
(2)高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,反应中均遵循电子守恒及质量守恒定律.
(2)高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,反应中均遵循电子守恒及质量守恒定律.
解答:解:(1)二氧化锰与浓盐酸反应生成氯化锰、水、氯气,由电子守恒及质量守恒定律可知,该反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,由电子守恒及质量守恒定律可知,该反应为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,由电子守恒及质量守恒定律可知,该反应为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意氧化还原反应中电子守恒,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
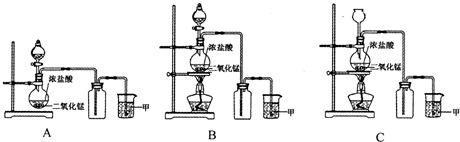


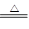 MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。