题目内容
用CuSO4?5H2O配制0.1mol?L-1CuSO4水溶液,下面所列的方法正确的是( )A.取25g CuSO4?5H2O溶于1L水中
B.将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1L溶液
C.将25g CuSO4?5H2O溶于水制成1L溶液
D.取12.5g CuSO4?5H2O溶于500mL水中
解答:解:A.应称取25gCuSO4?5H2O,配成1L溶液,水的体积不等于溶液的体积,故A错误;
B.没有必要干燥去掉结晶水,应直接称量,故B错误;
C.配制1L 1L 0.1摩/升硫酸铜溶液,需要硫酸铜晶体的物质的量是0.1mol,CuSO4?5H2O的摩尔质量是250g/mol,根据m(硫酸铜晶体)=M(硫酸铜晶体)?n,故需要硫酸铜晶体的质量是25g,然后把25克CuSO4?5H2O溶于适量水中,室温时稀释至1升,故C正确;
D.应称取12.5CuSO4?5H2O,配成500mL溶液,水的体积不等于溶液的体积,故D错误.
故选C.
点评:本题考查配制一定物质的量浓度的硫酸铜溶液,注意配制前后溶质的质量不变,难度较低.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
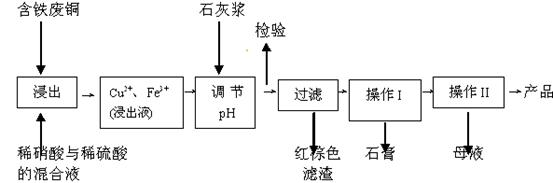
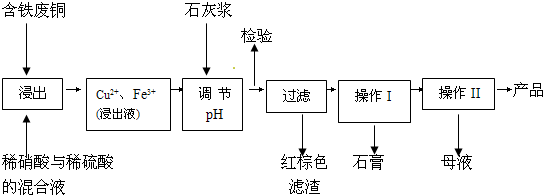
开心蛙口算题卡系列答案(11分)硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
| 温度( | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是 ;
(2)写出浸出过程中生成硫酸铜的离子方程式 ;
(3)操作I包括蒸发浓缩、 等操作,温度应该控制在  C左右;
C左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为 、 、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是 ;干燥时采用晾干,不用加热烘干的原因是 。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是 ;
②指出你认为不合理方案存在的问题是 。
(11分)硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
|
温度( |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32[来源:Z|xx|k.Com] |
0.26 |
0.15 |
0.11 |
0.07[来源:] |
|
胆矾 |
32 |
44.6 |
61.8 |
83.8[来源:学*科*网] |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是 ;
(2)写出浸出过程中生成硫酸铜的离子方程式 ;
(3)操作I包括蒸发浓缩、
等操作,温度应该控制在  C左右;
C左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为 、 、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是 ;干燥时采用晾干,不用加热烘干的原因是 。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是 ;
②指出你认为不合理方案存在的问题是 。
硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
| 温度( | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图: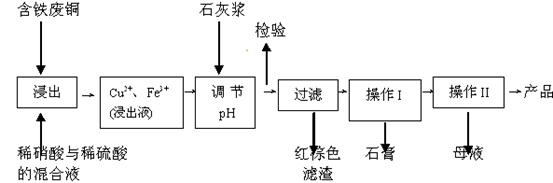
 C)
C)