题目内容
下列关于锌、铜和稀硫酸构成的原电池的说法中,正确的是( )
| A.锌是负极、铜是正极 |
| B.电子从铜片经导线流向锌片 |
| C.负极的反应式为2H++2e-=H2↑ |
| D.反应一段时间后,溶液的pH升高 |
AD
解析

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
下列说法正确的是
| A.工业上常通过电解熔融的MgO冶炼金属镁 |
| B.合金的硬度一般比其成分金属的硬度大 |
| C.钢铁发生吸氧腐蚀时,正极反应是4OH--4e-=2H2O+O2↑ |
| D.在铁上镀铜,应选用铜作阴极 |
下图为两个原电池装置图,由此判断下列说法错误的是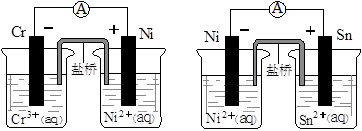
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是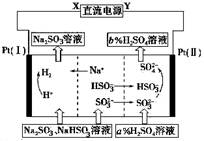
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
某种聚合物锂离子电池放电时的反应为Lil-xCoO2+LixC6=6C+LiCoO2,其电池如图所示。下列说法不正确的是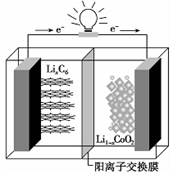
| A.放电时,LixC6发生氧化反应 |
| B.充电时,Li+通过阳离子交换膜从左向右移动 |
| C.充电时,将电池的负极与外接电源的负极相连 |
| D.放电时,电池的正极反应为Lil-xCoO2+xLi++ xe-=LiCoO2 |
已知空气锌电池的电极反应为
锌片:Zn+2OH--2e-=ZnO+H2O;
碳棒: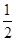 O2+H2O+2e-=2OH-,
O2+H2O+2e-=2OH-,
据此判断,锌片是( )。
| A.正极并被还原 | B.正极并被氧化 | C.负极并被还原 | D.负极并被氧化 |
茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、PtFe合金网为电极材料的海水电池。在这种电池中( )。
①铝合金是阳极 ②铝合金是负极 ③海水是电解质溶液 ④铝合金电极发生还原反应
| A.②③ | B.②④ | C.①③ | D.①④ |
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
| A.原电池放电时,负极上发生反应的物质是Zn |
| B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2 |
| C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。下列对该燃料电池的说法中,正确的是( )
| A.在熔融的电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10+13O2=8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为O2+4e-=2O2- |
| D.通入丁烷的一极是正极,电极反应为C4H10+26e-+13O2-=4CO2+5H2O |